Fundamentos da Coulombimetria, Tipos, Aplicações

- 1461
- 0
- Pete Wuckert
O Coulombimetria É uma técnica de análise eletroquímica que consiste na realização de uma eletrólise exaustiva, para que o analito possa ser quantificado; isto é, para determinar a concentração do analito nos problemas de problemas através de sua oxidação ou redução completa. É, diferentemente da potenciometria, uma técnica dinâmica, uma vez que a corrente pode fluir livremente através de células eletroquímicas.
Como o próprio nome sugere, a carga elétrica Q, nas unidades de Coulomb, C, é medida e correlacionada com a concentração do analito oxidado ou reduzido nas periferias do eletrodo. Portanto, os estados de oxidação da mudança de analito, ocorrendo no processo uma transferência e absorção dos elétrons que permitem o cálculo estequiométrico da concentração desejada.
 Montagem rudimentar para uma eletrólise na qual várias espécies coloridas são formadas devido ao pH e à complexação dos florestais presentes. Fonte: Steve Jurvetson, de Menlo Park, EUA, CC por 2.0, via Wikimedia Commons
Montagem rudimentar para uma eletrólise na qual várias espécies coloridas são formadas devido ao pH e à complexação dos florestais presentes. Fonte: Steve Jurvetson, de Menlo Park, EUA, CC por 2.0, via Wikimedia Commons Na Coulombimetria, uma bateria ou potenciostato é usado para controlar a corrente ou potencial aplicado às células. Essas células, diferentemente das potentiométricas, consistem em um sistema de três eletrodos e estão equipadas com um voltímetro e um amperímetro.
Coulombimetria apresenta a vantagem de poder executar diplomas sem preparar ou padronizar padrões. Também permite quantificar quantidades muito pequenas e limitadas de analito, como cátions metálicos, compostos inorgânicos e compostos orgânicos. Por exemplo, há um coulômetro projetado exclusivamente para medir o CO2 dissolvido em amostras do oceano.
Esta técnica oferece uma rota analítica diferente da volumétrica e potenciométrica, tantas análises, dependendo da natureza eletroquímica do analito, pode desenvolver Coulombimetricamente.
Fundamentos teóricos da coulombimetria
Lei de Faraday
A coulombimetria é baseada na lei de Faraday, que estabelece uma relação entre a carga elétrica de uma célula eletroquímica e a quantidade de analito que está oxidando ou reduzindo. Conhecendo essa carga q, bem como a carga de um elétron (1.6 · 10-19 C), você pode calcular o número de elétrons envolvidos em uma reação, ne-:
ne- = Q/E
Por outro lado, sabe -se que um mol de elétrons (6.02 · 1023) Porta uma carga elétrica igual a 96485 ° C, uma figura conhecida como constante de faraday:
F = inPARA
= 96485.3365 c/mol
Sendo conveniente para expressar a quantidade de elétrons, dependendo das toupeiras. Graças a isso, os coeficientes estequiométricos de uma reação eletroquímica podem ser usados, seja oxidação ou redução, levando em consideração quantas toupeiras de elétrons ganham ou perdem a espécie.
Pode atendê -lo: fosfato de sódio: estrutura, propriedades, síntese, usosCálculos básicos
Por exemplo, considere a seguinte equação química:
Ox + 2e- → Rede
Medindo que, quando toda a espécie de Ox foi reduzida a uma rede, podemos calcular as toupeiras de Ox usando fatores de conversão:
xq · (mol e- /96485.3365 c) · (mol Ox/ 2mol E-) = Mol Ox
Ou seja, como conhecemos a carga elétrica de um mol de elétrons, teremos quantos elétrons correspondem à carga XQ. Mas, por sua vez, cada 2 moles desses elétrons são usados para oxidar 1 mol de boi.
Esse raciocínio causa uma fórmula direta, mesmo que não seja recomendada para memorizá -la, mas para poder deduzi -la como foi feita:
n = Q/(Fñe-)
Onde ñe- É o número de moles de elétrons na equação química.
Desde que possa ser calculado q, independentemente do tipo de coulombimetria, os moles do OX ou analito de rede podem ser determinados; Enquanto, a eficiência da corrente é 100%. O último significa que toda a carga que deve ser o produto de apenas uma transformação, sem que outras espécies sejam reduzidas ou oxidadas.
Fundamentos experimentais de coulombimetria
Células
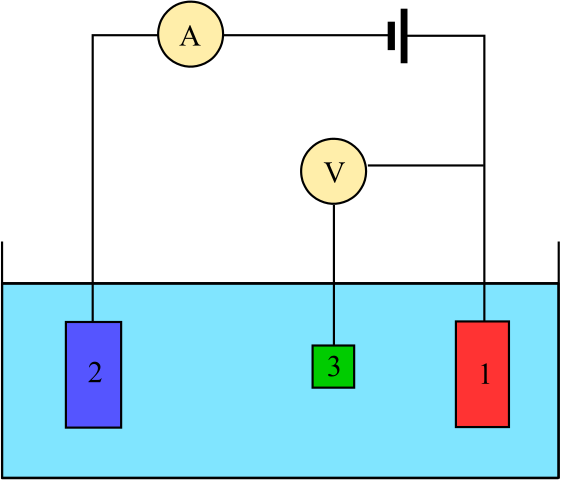 Diagrama para uma célula eletroquímica composta por três eletrodos: a referência (3), o assistente (2) e o trabalho (1). Fonte: Adam Rędzikowski, CC BY-SA 3.0, via Wikimedia Commons
Diagrama para uma célula eletroquímica composta por três eletrodos: a referência (3), o assistente (2) e o trabalho (1). Fonte: Adam Rędzikowski, CC BY-SA 3.0, via Wikimedia Commons Up, temos um diagrama para uma célula com três eletrodos, que são comumente usados em análises Coulombimétricas. A reação redox ocorre entre os eletrodos de trabalho (1) e auxiliar (2). Entre eles, dois estão conectados a bateria, para aplicar os potenciais à célula e o amperímetro (a), para medir as correntes elétricas.
No entanto, é necessário um eletrodo de referência (3) para poder monitorar o potencial do eletrodo de trabalho e, assim, conhecer a variação do potencial para o eletrodo auxiliar. Dessa forma, o potencial de toda a célula pode ser determinado ecélula, necessário para estimar o fim das reações redox em um dos tipos de coulombimetria.
Observe que entre o eletrodo de trabalho e o eletrodo de referência quase não flui a corrente devido ao voltímetro de alta impedância (V), graças ao qual há uma leitura do potencial do eletrodo de trabalho. Entre esses dois eletrodos, temos um sistema semelhante ao de uma análise potenciométrica: é estático e não é dinâmico.
Pode servir a você: Química Nuclear: História, Campo de Estudo, Áreas, AplicaçõesPotencial
A coulombimetria é, por assim dizer, uma eletrólise realizada para fins analíticos e quantitativos. Portanto, se fala na aplicação de potenciais externos, fornecidos por uma bateria, para realizar reações eletroquímicas não espontâneas; isto é, aqueles que têm potenciais negativos.
Considere, por exemplo, as seguintes reações acompanhadas de seus respectivos padrões em potencial:
Cu2+ + 2e- ⇌ Cu (s) Eºgrade = +0.337 v
H2Ou ⇌ 1/2o2(g) + 2h+ + 2e- Eºgrade = +1.230 v
Sendo a equação da reação global igual a:
Cu2+ + H2Ou ⇌ Cu (s) + 1/2o2(g) + 2h+ Eºgrade = -0.893 v
A bateria deve aplicar um potencial de 0.893 V para que o eletrodo de cobre e a formação de íons de hidrogênio sejam possíveis. Este potencial é o Ecélula. No entanto, na prática, um potencial maior que o calculado deve ser aplicado, porque existem potenciais que se opõem à evolução da reação:
Ecélula = Ecátodo - Eânodo - Op - ir - cp
Onde,
OP: superpotencial (barreira cinética)
IR: ôndmico (potencial intrínseco para as células)
CP: polarização das concentrações (produto das reduções no Cu2+)
Tipos de coulombimetria
Existem três tipos de coulombimetria: amorestático, potenciostático e eletrográfico eletrográfico eletrogravimétrico.
Amperiostático ou galvanostático
Nesse tipo de coulombimetria, a corrente que atravessa a célula é constante usando um amorestado. Portanto, tendo o atual Yo Graças à leitura do amperímetro e também ao saber o tempo t Quando a eletrólise termina, podemos calcular a carga associada à transformação do analito:
Q = Item
Uma conseqüência de manter a constante atual é que os eletrodos possam mudar, positiva ou negativamente. Essa variação repentina é indicativa de que o analito reagiu completamente, que é quando a eletrólise para e é medida t. Esta é a base para graus coulométricos.
Se o potencial continuar ou fazer upload, outras espécies eletroativas indesejáveis acabarão reagindo. É por isso que os potenciais associados às transformações de interesse devem ser conhecidos perfeitamente.
Potenciostático
Uma maneira de prevenir outras espécies. É aqui onde entra a coulombimetria potenciótica, porque usa um potencitete para definir um certo potencial para a célula. Ao contrário da Coulombimetria amoresática, agora é a corrente que muda à medida que o tempo ocorre.
Pode atendê -lo: tolueno: estrutura, propriedades, usos, obtençãoDevido a esta configuração técnica, não podemos calcular isso diretamente com os valores de Yo e t; A corrente diminui ao longo do tempo. Isso ocorre porque, à medida que o analito reage, haverá cada vez menos moléculas ou átomos que doam ou aceitam elétrons. Portanto, que é igual a uma área integral sob a curva gráfica Yo vs t.
Eletrográfico
Coulombimetria eletrográfica, simplesmente conhecida como eletrogravimetria, é uma eletrólise na qual não é necessário medir cargas ou correntes elétricas. Em vez disso, as massas dos eletrodos são medidas antes e depois da eletrólise.
Essa técnica se aplica apenas quando as espécies reduzidas são cátions metálicos que são eletrodepos nos eletrodos, tornando -os mais pesados.
Formulários
Potenciostético
Análises potenciostéticas permitem reduzir ou oxidar seletivamente uma espécie de cada vez no meio de uma mistura. Por exemplo, eles são usados para determinar a concentração dos seguintes íons inorgânicos em quantidades de traços ou em matrizes complexas:
-Cu2+
-Ás3+
-CD2+
-Co2+
-Fé2+ e fé3+
-PB2+
-X (f-, Cl-, Br- e eu-)
-Nenhum2+
-Pu3+
-AG+
-Sn2+
-Zn2+
-OU6+
Além disso, essas análises podem ser usadas para determinar a composição de uma liga. Uma vez dissolvido a liga ácida, os potenciais celulares são aplicados de maneira escalonada e controlada, determinando assim a quantidade reduzida para cada cátion metal que a integra.
Graus coulométricos
Nos graus coulométricos, são usados agentes mediantes que se certificam de neutralizar ou reagir completamente com o analito restante. O objetivo disso é evitar possíveis variações, para uma corrente constante, derivam em reações colaterais. Assim, é possível suporte, por exemplo, ácido ascórbico usando iodo como mediador.
Alguns cátions de metal, como AG+, EC3+, Fé3+, Mn2+, Você3+, Cr2+, Eles também podem ser determinados por esses graus.
Por outro lado, as reações ácidas-base ainda podem usar essa técnica, uma vez que grandes potenciais fazem com que a água seja iônica3QUALQUER+ ou oh-, que servem de agentes -título que são gerados in situ; isto é, eles neutralizarão os ácidos ou as bases presentes.
O co2 do oceano, as reações de precipitação e a formação de complexos com o EDTA, também são possíveis para analisá -las aplicando graus coulométricos, onde indicadores redox são adicionados para destacar o ponto final da eletrólise.
Referências
- Dia, r., & Underwood, um. (1986). Química analítica quantitativa (Quinta ed.). Pearson Prentice Hall.
- Skoog d.PARA., Oeste d.M. (1986). Análise instrumental. (Segunda ed.). Inter -American., México.
- Dr. Doug Stewart. (2020). Definição de coulometria. Recuperado de: Chemicool.com
- Wikipedia. (2020). Coulometria. Recuperado de: em.Wikipedia.org
- Harvey David. (5 de junho de 2019). Métodos coulométricos. Química Librettexts. Recuperado de: química.Librettexts.org
- « Estrutura metodológica Como escrevê -lo, estrutura, exemplos
- Origem da filosofia contemporânea, características, correntes, autores »

