Configuração eletrônica externa
- 4434
- 809
- Melvin Mueller
 Orbitais eletrônicos. Fonte: Patricia.Fidi, Wikimedia Commons
Orbitais eletrônicos. Fonte: Patricia.Fidi, Wikimedia Commons O que é configuração eletrônica externa?
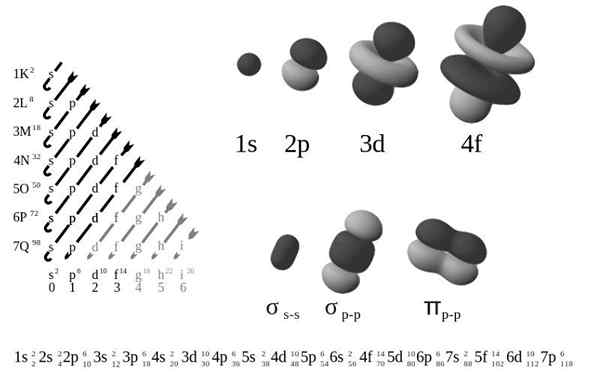
O Configuração eletrônica externa, Também chamado de estrutura eletrônica, é o arranjo de elétrons nos níveis e sub -níveis de energia em torno de um núcleo atômico. Os níveis são de 1 a 7, e os sub -níveis são S, P, D e F.
De acordo com o antigo modelo atômico de Bohr, os elétrons ocupam vários níveis em órbitas ao redor do núcleo, da primeira camada mais próxima do núcleo, K, para a sétima camada, q, o mais distante.
Em termos de um modelo mecânico quântico mais refinado, as camadas K-Q são subdivididas em um conjunto de orbitais, cada um dos quais pode ser ocupado por não mais que alguns elétrons.
Geralmente, a configuração eletrônica é usada para descrever os orbitais de um átomo em seu estado fundamental, mas também pode ser usado para representar um átomo que foi ionizado em um cátion ou ânion, compensando a perda ou ganho de elétrons em seus respectivos orbitais.
Muitas das propriedades físicas e químicas dos elementos podem ser correlacionadas com suas configurações eletrônicas únicas. Os elétrons de Valência, elétrons na camada mais externa, são o fator determinante para a química única do elemento.
Conceitos básicos de configurações eletrônicas
Antes de atribuir os elétrons de um átomo aos orbitais, é preciso se familiarizar com os conceitos básicos de configurações eletrônicas. Cada elemento da tabela periódica consiste em átomos, compostos por prótons, nêutrons e elétrons.
Os elétrons exibem uma carga negativa e estão ao redor do núcleo do átomo nos orbitais de elétrons, definidos como o volume do espaço em que o elétron pode ser encontrado com 95% de probabilidade.
Os quatro tipos diferentes de orbitais (S, P, D e F) têm maneiras diferentes, e um orbital pode conter no máximo dois elétrons. Os orbitais P, D e F têm sub -níveis diferentes, para que possam conter mais elétrons.
Pode atendê -lo: reator em lote: características, peças, aplicaçõesConforme indicado, a configuração eletrônica de cada elemento é única para sua posição na tabela periódica. O nível de energia é determinado pelo período e o número de elétrons é dado pelo número atômico do elemento.
Os orbitais em diferentes níveis de energia são semelhantes entre si, mas ocupam diferentes áreas no espaço.
O 1S orbital e os 2s orbitais têm as características de um orbital (nós de rádio, probabilidades de volume esférico, podem conter apenas dois elétrons, etc.). Mas, como estão em diferentes níveis de energia, eles ocupam diferentes espaços ao redor do núcleo. Cada orbital pode ser representado por blocos específicos na tabela periódica.
O bloco S é a região dos metais alcalinos, incluindo hélio (grupos 1 e 2), o bloco D são metais de transição (grupos 3 a 12), o bloco P são os elementos do grupo principal de grupos 13 a 18 e o bloco F são A série de Lantanides e Actinids.
Princípio da Aufbau
Aufbau vem da palavra alemã Aufbauen, O que significa "construir". Em essência, ao escrever configurações de elétrons, estamos construindo orbitais de elétrons à medida que avançamos de um átomo para outro.
Enquanto escrevemos a configuração eletrônica de um átomo, preencheremos os orbitais em uma ordem crescente de número atômico.
O princípio da Aufbau se origina do princípio de exclusão de Pauli, que diz que não há dois férmions (por exemplo, elétrons) em um átomo. Eles podem ter o mesmo conjunto de números quânticos, então precisam "acumular" em níveis mais altos de energia.
A maneira como os elétrons se acumulam é um problema de configuração de elétrons.
Os átomos estáveis têm tantos elétrons quanto os prótons no núcleo. Os elétrons se reúnem ao redor do núcleo em orbitais quânticos, seguindo quatro regras básicas chamadas princípios de Aufbau.
Pode servir você: cloreto de bário (BACL2)1. Não há dois elétrons no átomo compartilhados pelos mesmos quatro números quânticos n, l, me.
2. Os elétrons ocuparão primeiro os orbitais do menor nível de energia.
3. Os elétrons vão preencher os orbitais sempre com o mesmo número de rotação. Quando os orbitais estiverem cheios, ele começará.
4. Os elétrons preencherão orbitais para a soma dos números quânticos N e L. Os orbitais com valores iguais (n + l) serão preenchidos primeiro com valores mais baixos de n.
A segunda e a quarta regras são basicamente as mesmas. Um exemplo da Regra Quatro seria os orbitais 2p e 3s.
Um orbital 2p é n = 2 e l = 2 e um orbital 3s é n = 3 e l = 1. (N + l) = 4 em ambos os casos, mas o orbital 2p tem a menor energia ou menor valor e será preenchido antes da camada 3s.
Felizmente, você pode usar o diagrama Moeller mostrado para encher elétrons. O gráfico é lido executando as diagonais de 1s.
 Diagrama de Moeller. Fonte: Gabriel Bolívar
Diagrama de Moeller. Fonte: Gabriel Bolívar Agora que se sabe que a ordem dos orbitais está preenchida, a única coisa que resta é memorizar o tamanho de cada orbital.
Os orbitais têm 1 valor possível de meu Para conter 2 elétrons
P orbitais têm 3 valores possíveis de meu Para conter 6 elétrons
Os orbitais têm 5 valores possíveis de Meu Para conter 10 elétrons
Os orbitais têm 7 valores possíveiseu Para conter 14 elétrons
Isso é tudo o que é necessário para determinar a configuração eletrônica de um átomo estável de um elemento.
Por exemplo, pegue o elemento de nitrogênio. O nitrogênio tem sete prótons e, portanto, sete elétrons. O primeiro orbital a preencher é o Orbital 1s.
Um orbital S tem dois elétrons, então restam cinco elétrons. O próximo orbital é o 2S orbital e contém os próximos dois. Os três elétrons finais irão para o orbital 2p que pode conter até seis elétrons.
Pode atendê -lo: carboximetilceluloseImportância da configuração eletrônica externa
As configurações de elétrons desempenham um papel importante na determinação das propriedades do Atom.
Todos os átomos do mesmo grupo têm a mesma configuração eletrônica externa, com exceção do número atômico n, e é por isso que eles têm propriedades químicas semelhantes.
Alguns dos principais fatores que influenciam as propriedades atômicas incluem o tamanho dos maiores orbitais ocupados, a energia dos mais orbitais de energia, o número de vagas orbitais e o número de elétrons nos orbitais de maior energia.
A maioria das propriedades atômicas pode estar relacionada ao grau de atração entre os elétrons externos ao núcleo e o número de elétrons na camada de elétrons mais externos, o número de elétrons de valência.
Os elétrons da camada externa são aqueles que podem formar ligações químicas covalentes, que têm a capacidade de formar cátions ou ânions e aqueles que dão o estado de oxidação aos elementos químicos.
Eles também determinarão o raio atômico. À medida que N se torna maior, o raio atômico aumenta. Quando um átomo perde um elétron, haverá uma contração do raio atômico devido à diminuição da carga negativa ao redor do núcleo.
Os elétrons da camada externa são levados em consideração pela teoria do vínculo de Valência, teoria do campo cristalino e teoria orbital molecular para obter as propriedades das moléculas e as hibridizações dos vínculos.
Referências
- Aufbau Main. Química recuperada.Librettexts.org.
- Ciência Bozeman. Configuração de elétrons. Recuperado do YouTube.com.
- Configurações de elétrons e propriedades dos átomos. Recuperado de Oneonta.Edu.

