Concentração química

- 737
- 152
- Tim Mann
 Concentração química é o que determina a proporção de um soluto e um solvente em uma solução química
Concentração química é o que determina a proporção de um soluto e um solvente em uma solução química O que é concentração química?
O Concentração química É uma propriedade das soluções que representa a quantidade de soluto para cada unidade de solução. Em outras palavras, é um número que indica a proporção em que o soluto e o solvente estão localizados.
Lembre -se de que uma solução é uma mistura homogênea formada por um solvente (geralmente líquido) e uma ou mais substâncias dissolvidas no solvente que chamamos de solutos. As soluções são caracterizadas pelo solvente, o soluto e a concentração.
A concentração é uma propriedade muito útil, pois nos permite descrevê -los. Por exemplo, se soubermos que a concentração de sal na água do mar é de 35 gramas para cada litro, sabemos que, em nossa casa dissolvemos 35 gramas de sal em um litro de solução, obteremos uma solução igual de salgada que a água do mar.
Características da concentração química
É uma propriedade intensiva
Esta é a principal característica da concentração. Intensivo significa que não depende da quantidade de solução que temos. Como exemplo, isso significa que a concentração é a mesma em uma gota de água do mar do que em 100 litros do mesmo.
Pode variar com a temperatura
Em geral, os líquidos expandem ou aumentam seu volume ao aquecer. Isso também é verdade para soluções. Por esse motivo, as concentrações expressas, dependendo do volume, podem mudar um pouco ao aquecer ou resfriar a solução.
Pode cobrir faixas de alcance muito amplo
Independentemente das unidades em que uma concentração química é expressa, pode ter de valores relativamente grandes, a valores extremamente pequenos.
Por exemplo, a concentração de uma solução expressa em porcentagem pode ter valores de 0% a 100%, cobrindo muitas ordens de magnitude. Poderíamos preparar uma solução de 90%, pois também poderíamos preparar um por 10-12%, que é quase 14 ordens de magnitude menor.
Para que é a concentração química para?
Saber a concentração de uma solução nos permite descrevê -la. Existem muitas propriedades de soluções que dependem de sua concentração. Por exemplo, o ponto de fusão e ebulição depende da concentração, portanto, saber que ela nos permite calcular essas duas propriedades.
Pode atendê -lo: estado vítreoPor outro lado, a concentração nos permite comparar facilmente uma solução com outra. Se tivermos duas soluções de água com açúcar, saber que suas concentrações nos permitirão saber qual dos dois é mais doce.
Além disso, todas as reações químicas que tornam a vida possível dependem fortemente da concentração de solutos intermináveis nas células e nos arredores dos seres vivos.
Por exemplo, a concentração de oxigênio no ar determina se uma pessoa sufocará ou não; O pH de uma solução (que é uma maneira de medir a concentração de íons h+) Determinar se uma bactéria viverá e se reproduzirá ou se, pelo contrário, morrerá; e a concentração de um veneno determinará se será letal ou não.
Tipos de unidades de concentração
A concentração de uma solução é uma, por isso não é correto falar sobre tipos de concentração. No entanto, a mesma concentração pode ser expressa em diferentes tipos de unidades de concentração. Estes são:
- Unidades de concentração física
- Unidades de concentração química
Unidades de concentração física
Estes são caracterizados por expressar as quantidades do soluto e o solvente em unidades de massa ou volume. Eles são chamados de unidades físicas, pois estão associadas a massas e volumes em vez de toupeiras e equivalentes.
Quando comparamos duas soluções que têm a mesma concentração física, não podemos garantir que elas tenham quantidades iguais de átomos e moléculas. É isso que os distingue das unidades de concentração química.
As unidades físicas mais comuns de concentração são:
- Título simples (TS)
- %de peso/peso (%p/p) ou massa/massa (%m/m)
- %de peso/volume (%p/v) ou massa/volume (%m/v)
- % de volume/volume (% v/v)
- Peças por milhão de peso/peso (ppmp/p) ou massa/massa (ppmmilímetros)
- Peças por milhão de peso/volume (ppmp/v) ou massa/volume (ppmm/v)
- Peças por milhão de volume/volume (ppmV/v)
Unidades de concentração química
No caso de unidades químicas, a quantidade de soluto e, em alguns casos, a do solvente ou da solução, é expressa em termos do número de partículas ou moles ou equivalentes presentes na solução.
Eles são chamados de unidades químicas, uma vez que duas soluções que têm a mesma concentração química têm quantidades equivalentes de átomos, moléculas ou íons solutos por unidade de solução, como o caso pode ser.
Pode atendê -lo: regras de solubilidade: aspectos e regras geraisAs unidades químicas mais comuns são:
- Molaridade (M)
- Molalidade (M)
- Fração molar (x)
- Normalidade (n)
Fórmula de unidades de concentração física
Título simples (TS)
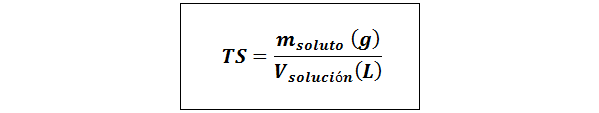
Onde msoluto representa a massa do soluto em gramas e vsolução É o volume da solução em litros.
%de peso/peso (%p/p) ou massa/massa (%m/m)
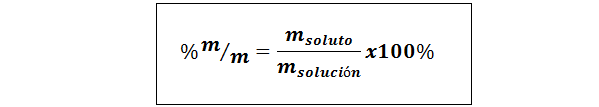
Onde msoluto e msolução respectivamente representam a massa do soluto e a solução. Qualquer unidade de massa pode ser usada (g, mg, kg, etc.), desde que ambas as massas sejam expressas na mesma unidade.
%de peso/volume (%p/v) ou massa/volume (%m/v)
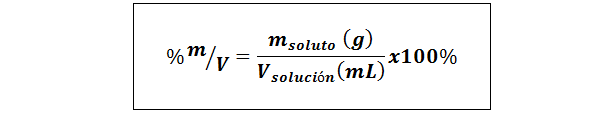
Onde msoluto É a massa da solução em gramas e vsolução É o volume da solução, neste caso em mililitros.
% de volume/volume (% v/v)

Onde Vsoluto e Vsolução respectivamente representam o volume do soluto e a solução. Nesse caso, qualquer unidade pode ser usada para expressar esses volumes, desde que seja o mesmo para ambos.
Peças por milhão de peso/peso (ppmp/p) ou massa/massa (ppmmilímetros)
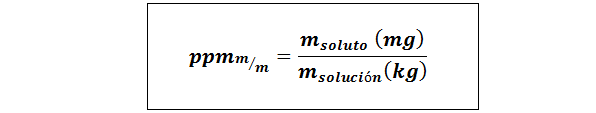
Onde msoluto e msolução Eles representam a massa do soluto e a solução em miligramas e quilogramas, respectivamente.
Peças por milhão de peso/volume (ppmp/v) ou massa/volume (ppmm/v)
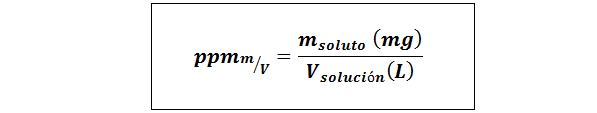
Onde msoluto É a massa da solução em miligramas e vsolução É o volume da solução, neste caso em litros.
Peças por milhão de volume/volume (ppmV/v)
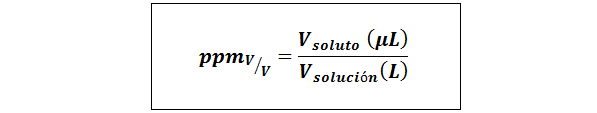
Onde Vsoluto e Vsolução Eles são o volume do soluto e a solução em microlitros e litros, respectivamente.
Fórmulas das unidades de concentração química
No caso de unidades de concentração química, a quantidade de componentes da solução, em particular do soluto, é expressa em número de moles ou em número de equivalentes. Essas quantidades têm o número real de partículas (átomos, moléculas ou íons, conforme o caso).
Essas quantidades não podem ser conhecidas simplesmente pesando ou medindo o volume de substâncias, mas é necessário conhecer a composição ou fórmula química dos compostos para determinar a concentração. Esta é a principal razão pela qual eles são chamados de concentrações químicas.
Em seguida, as diferentes fórmulas são apresentadas para calcular as quatro concentrações químicas mais usadas:
Molaridade (M)
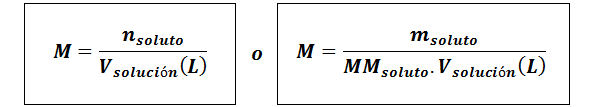
Ondesoluto Eles são as toupeiras de soluto, Msoluto representa a massa do soluto em gramas, mmsoluto é sua massa molar e vsolução É o volume da solução em litros.
Molalidade (M)
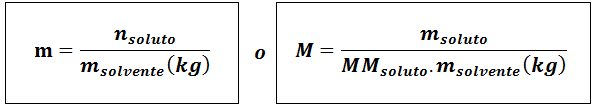
Ondesoluto Eles são as toupeiras de soluto, Msoluto representa a massa do soluto em gramas, mmsoluto É sua massa molar e msolvente É a massa do solvente em quilogramas.
Pode atendê -lo: solvationFração molar (x)
A fração molar pode ser calculada para o soluto e o solvente. A fração molar do soluto é:
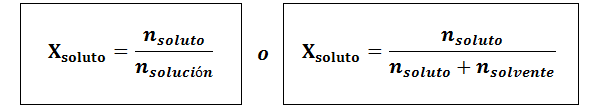
O solvente é:
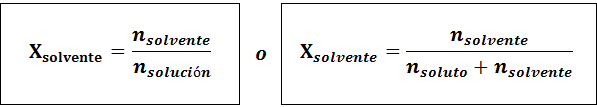
A relação entre as duas frações molares é:
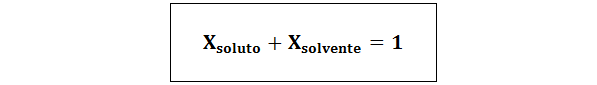
Em todos os casos nsoluto, nsolução e nsolvente são as moles de soluto, solução e solvente, respectivamente.
Normalidade (n)
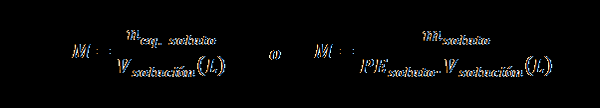
Aqui nEq. soluto representa o número de equivalente ao soluto, msoluto representa a massa do soluto, PEsoluto É o peso equivalente do soluto e Vsolução É o volume da solução em litros.
Exemplos de concentração química
- A concentração de sal na água marinha é de 35 g/L, o que corresponde a uma molaridade de 0,60 mol/L.
- A concentração média de açúcar no sangue está entre 82 mg/dL e 110 mg/dl. Essas concentrações são equivalentes a um título simples a 0,82 g/L e 1,10 g/L, e em molaridade em 4,4.10-3 mol/l e 6.1.10-3 mol/l, respectivamente.
- O ar pode ser considerado uma solução gasosa formada principalmente por nitrogênio e oxigênio, sendo o solvente nitrogênio, pois está em maior proporção. Esta solução de gás contém uma fração de 0,22 oxigênio e nitrogênio de aproximadamente 0,78.
- O aço é uma liga entre ferro e carbono. Embora não sejam soluções estritamente, essas são misturas sólidas homogêneas que geralmente contêm uma concentração de carbono na ordem de 0,03% e 1.075% em massa.
- Apesar de seus efeitos devastadores para o meio ambiente e para a saúde dos seres humanos, as concentrações de muitos poluentes geralmente são consideravelmente baixas. Um exemplo é a concentração máxima de metal venenoso de arsênico na água. A Organização Mundial da Saúde (OMS) estabeleceu que a água potável não deve conter uma concentração de arsênico superior a 10ppb m/v (peças por bilhão ou nanogramas por litro). Esta concentração é equivalente a 0.010 ppm m/v.
Referências
- BBC (s. F.). Concentração de soluções - cálculos em química - AQA - GCSE Chemistry (Single Science) Revisão - AQA. BBC tomado.co.Reino Unido.
- Aqui está o que a concentração significa em química (2020). Break do pensamento.com.
- Librettexts (2022). 4.5: Concentração de soluções. Retirado de Chem.Librettexts.org.
- Mandal, a., MD. (2021). Valores normais de açúcar no sangue. Retirado de notícias médicas.líquido.
- Produtos químicos.Rede (s. F.). Concentrações químicas. Tirado de química.líquido.

