Estrutura de cloreto de ferro (iii), propriedades, obtenção, uso
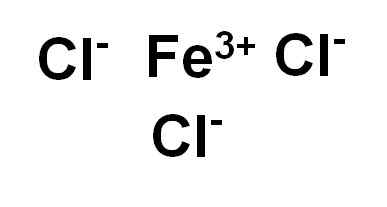
- 3926
- 770
- Alfred Kub
Ele Cloreto de ferro (III) É um composto inorgânico formado pelos elementos de ferro (fé) e cloro (CL). Sua fórmula química é FECL3. É um sólido cristalino cuja cor pode ser de laranja a marrom escuro.
O FECL3 É facilmente dissolvido na água que formam soluções aquosas ácidas nas quais aumentando o pH, tornando -os mais alcalinos.
 Cloreto de ferro (III) ou FECL de cloreto férrico3 sólido. Го ои/cc by-SA (https: // criativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons.
Cloreto de ferro (III) ou FECL de cloreto férrico3 sólido. Го ои/cc by-SA (https: // criativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons. O cloreto de ferro (III) é usado para sedimentar as partículas que poluem as águas residuais municipais ou industriais. Dizem que ele permite remover alguns parasitas e servir para impedir as perdas de sangue de animais em animais e para a cura destes.
Serve para extrair cobre (ii) de minerais de sulfeto de cobre. Também é usado em várias reações químicas e análise de laboratórios biológicos e químicos. Por exemplo, serve para detectar compostos como fenóis em óleos extraídos de plantas. É usado em circuitos eletrônicos, no curtidor de couro e na fotografia.
Por ser o FECL3 Um composto ácido é corrosivo para as membranas de pele e mucosas. O pó deste composto deve ser evitado. Não deve ser descartado para o meio ambiente.
[TOC]
Estrutura
Cloreto de ferro (III) ou FECL de cloreto férrico3 É um composto iônico e é formado por uma fé férrica3+ e três íons cloreto cl-. O ferro está em seu estado de oxidação de +3 e cada cloro tem Valência -1.
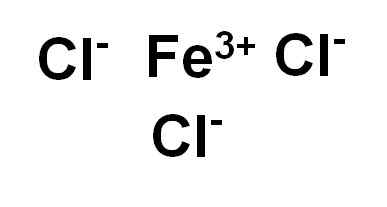 Cloreto de ferro (III) ou cloreto férrico. Autor: Marilú Stea.
Cloreto de ferro (III) ou cloreto férrico. Autor: Marilú Stea. Nomenclatura
- Cloreto de ferro (III)
- Cloreto férrico
- Tricloreto de ferro
- Muriatura de ferro
Propriedades
Estado físico
Laranja sólida cristalina a marrom escuro.
 FECL de cloreto férrico3 anidro (sem água). LEIEM/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0). Fonte: Wikimedia Commons.
FECL de cloreto férrico3 anidro (sem água). LEIEM/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0). Fonte: Wikimedia Commons. Peso molecular
Anhidro FECL3 = 162,2 g/mol
Ponto de fusão
Anhidro FECL3 = 304 ºC
Hexa -hidrato fecl3 •6h2O = 37 ° C
Ponto de ebulição
Anhidro FECL3 = Aproximadamente 316 ºC
Hexa -hidrato fecl3 •6h2O = 280-285 ° C
Densidade
Anhidro FECL3 = 2,90 g/cm3 a 25 ° C
Solubilidade
Muito solúvel em água: 74,4 g/100 g de água a 0 ° C; 535,7 g/100 g de água a 100 ° C. Muito solúvel em acetona, etanol, éter e metanol. Fracamente solúvel em solventes não polares como benzeno e hexano.
Pode atendê -lo: boro: história, propriedades, estrutura, usosph
Suas soluções aquosas são muito ácidas. Uma solução de 0,1 moles de FECL3 por litro de água tem um pH de 2,0.
Propriedades quimicas
Quando o fadl se dissolve na água3 Está hidrolisado; isto é, ele se separa em seus íons fé3+ e 3 cl-. Fé3+ formar o íon hexaacuohierro [fé (h2QUALQUER)6]3+ Mas isso é combinado com íons oh- da água formando espécies mistas e liberando prótons h+.
Por esse motivo, suas soluções são ácidas. Se o pH estiver aumentando, essas espécies formam um gel e, finalmente, um precipitado ou sólido de fé de óxido férrico hidratado é formado2QUALQUER3 •NH2QUALQUER.
Os cristais de cloreto de ferro (III) são higroscópicos, ou seja, absorvem a água do ambiente. Quando está molhado, é corrosivo para alumínio e muitos metais.
 Soluções FECL3 Eles podem ser muito ácidos e corrosivos, porque contêm HCl. KANESSKONG/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0). Fonte: Wikimedia Commons.
Soluções FECL3 Eles podem ser muito ácidos e corrosivos, porque contêm HCl. KANESSKONG/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0). Fonte: Wikimedia Commons. Soluções aquosas do FECL3 Eles são muito ácidos e corrosivos para a maioria dos metais. Eles têm um cheiro fraco de ácido clorídrico HCl. Quando o FECL é aquecido até sua decomposição3 emite gases HCl altamente tóxicos.
Obtenção
O cloreto de ferro (III) é produzido pela cloração direta de ferro reagindo cloro seco (CL2) Com sucata de ferro (fé) a 500-700 ° C.
A reação é realizada em um reator ácido resistente. O primeiro passo é derreter a 600 ° C uma mistura de cloreto de ferro (III) (FECL3) e cloreto de potássio (KCl).
 O FECL3 Deve ser preparado em recipientes muito resistentes a ácidos como aço inoxidável. Autor: Johannes Plenio. Fonte: Pixabay.
O FECL3 Deve ser preparado em recipientes muito resistentes a ácidos como aço inoxidável. Autor: Johannes Plenio. Fonte: Pixabay. Então o pedaço de ferro (fé) é dissolvido nessa mistura derretida onde o ferro reage com o FECL3 E se torna cloreto ferroso (FECL2).
Fe + 2 FECL3 → 3 FECL2
Então o FECL2 reage com cloro cl2 formando o FECL3 que sublima (passa do estado sólido para o gasoso diretamente) e é coletado em câmaras de condensação especiais.
2 FECL2 + Cl2 → 2 FECL3
Você também pode reagir Feso Sulfato Ferroso4 com cloro cl2.
Hexa -hidrato fecl3 •6h2O pode ser obtido evaporando uma solução aquosa de íons de fé3+ e cl- Em um banho de vapor.
Pode atendê -lo: compostos quaternários: características, treinamento, exemplosPresença na natureza
O cloreto férrico ou cloreto de ferro (III) é encontrado na forma na forma do mineral mineral, que é encontrado na lava do vulcão ativo Fumaroles. Entre os vulcões onde você pode encontrar está o Monte Vesubio.
 O FECL3 Faz parte do minério moysite que está em vulcões ativos. Autor: espeto. Fonte: Pixabay.
O FECL3 Faz parte do minério moysite que está em vulcões ativos. Autor: espeto. Fonte: Pixabay. Formulários
Em tratamento de águas residuais
O cloreto férrico é usado para tratar águas residuais municipais ou industriais por sedimentação química.
Atua como um coagulante que favorece a união de várias partículas entre si, dessa maneira, são formados conglomerados ou partículas maiores que tendem a flocculares ou sedimentos (diminuindo seu próprio peso no fundo da água que está sendo tratado).
 O FECL3 É usado para separar materiais indesejáveis das águas descartadas por comunidades ou indústrias. Autor: 后园 卓. Fonte: Pixabay.
O FECL3 É usado para separar materiais indesejáveis das águas descartadas por comunidades ou indústrias. Autor: 后园 卓. Fonte: Pixabay. Dessa maneira, a separação de sólidos de água é favorecida e isso é livre de materiais indesejados.
Esse tipo de tratamento pode facilitar a remoção de parasitas, como protozoários, que são microorganismos formados por uma única célula, como os amibas, que causam doença.
Por esse motivo, o FECL3 Também é usado para purificar a água.
Em procedimentos de cicatrização veterinária
O cloreto de ferro (III) é usado para curar lesões de animais.
Serve como adstringente local (você pode retrair tecidos e atuar como anti -inflamatório e cura) e hemostático (para de sangramento ou perda de sangue).
É usado em pós para interromper as perdas de sangue ou quando os cavalos foram cortados para o gado. Também é usado em uma solução para parar de sangrar quando as garras são cortadas ou verrugas são eliminadas.
 O FECL3 É usado em pós aplicados às vacas cortadas e evitam infecções. Autor: Jaclou DL. Fonte: Pixabay.
O FECL3 É usado em pós aplicados às vacas cortadas e evitam infecções. Autor: Jaclou DL. Fonte: Pixabay. Também é usado para tratar a faringite (inflamação da faringe) ou estomatite (inflamação da mucosa oral) e para aumentar a hemoglobina no sangue em algumas aves.
Em extração de metal
Cloreto de ferro (III) ou FECL de cloreto férrico3 É usado para extrair cobre (ii) de minério de cobre contendo sulfetos do referido metal.
Pode atendê -lo: hidróxidosÉ um método oxidativo que é adequado para evitar a liberação de dióxido de enxofre a gás tóxico (então2), porque em vez disso é gerado por enxofre (s). Soluções com altas concentrações de FECL são produzidas2, FECL3, CUCL2 e outros cloretos de metal.
4 FECL3 + Cu2S ⇔ 4 FECL2 + 2 CUCL2 + S age
Como reagente de laboratórios químicos e biológicos
Entre muitos de seus usos de química, serve para indicar a presença do grupo fenólico (ou seja, o grupo -Oh anexado a um anel de benzeno).
O composto é dissolvido para ser analisado em etanol e algumas gotas de solução de FECL são adicionadas3. Quando o composto tem um grupo -Oh conectado a um anel de benzeno (ou seja, é um fenol), uma coloração verde azulada é formada.
Este teste permite analisar a presença de fenóis em extratos de plantas.
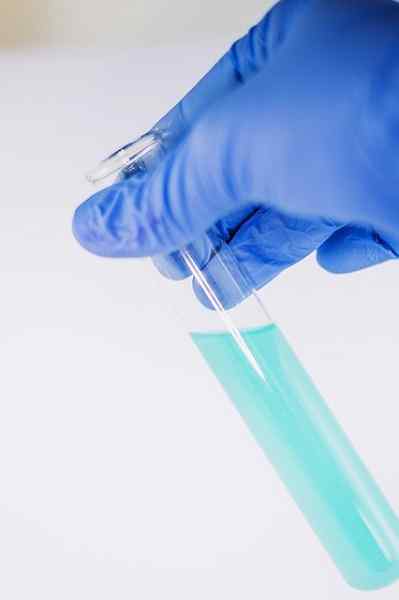 O FECL3 Na presença de fenóis, dá uma coloração verde azulada. Autor: Ewa Urban. Fonte: Pixabay.
O FECL3 Na presença de fenóis, dá uma coloração verde azulada. Autor: Ewa Urban. Fonte: Pixabay. Também é usado em testes para determinar a atividade antioxidante de certos óleos extraídos de vegetais.
Outra de suas aplicações é que ele permite preparar outros compostos químicos. Também pode atuar como um agente oxidante e clorinado (fornecer cloro) e condensador (para se juntar a duas ou mais moléculas entre si).
Também serve como catalisador ou acelerador de reações químicas orgânicas.
Em várias aplicações
O cloreto férrico é usado em circuitos eletrônicos impressos. Pela coloração de suas várias formas hidratadas, ele serve como pigmento e é usado no curtidor de couro.
 O FECL3 É usado em bronzeamento de couro. Autor: Pexels. Fonte: Pixabay.
O FECL3 É usado em bronzeamento de couro. Autor: Pexels. Fonte: Pixabay. É desinfetante. É usado para tratar distúrbios da pele e também é usado na fotografia.
Riscos
FECL em pó3 É irritante para os olhos, nariz e boca. Se a inspiração pode causar tosse ou dificuldade em respirar. É um composto corrosivo, portanto, o contato prolongado com a pele e com os olhos ou membranas mucosas pode causar vermelhidão e queimaduras.
Não é inflamável, mas quando aquecido a altas temperaturas produz gás cloreto de hidrogênio HCl, que é tóxico e muito corrosivo.
O FECL3 É prejudicial para organismos aquáticos e terrestres. Se por acidente for descartado para o meio ambiente, sua acidez com compostos básicos deve ser neutralizada.
Referências
- OU.S. Biblioteca Nacional de Medicina. (2019). Cloreto férrico. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Kirk-Othmer (1994). Enciclopédia de tecnologia química. Volume 19. Quarta edição. John Wiley & Sons.
- Enciclopédia de química industrial de Ullmann. (1990). QUINTA EDIÇÃO. Volume A22. Vch verlagsgellschaft mbh.
- Ngameni, b. et al. (2013). Flavonóides e compostos relacionados das plantas medicinais da África. Caracterização de flavonóides em extratos de plantas. Teste de cloreto férrico. Na pesquisa de plantas medicinais na África. Recuperado de cientedirect.com.
- Agyare, c. et al. (2017). Petroselinum crispum: uma revisão. Atividade antioxidante. Em Spartes e vegetais medicinais da África. Recuperado de cientedirect.com.
- Stott, r. (2003). Destino e comportamento de parasitas em sistemas de tratamento de águas residuais. Sedimentação quimicamente assistida. No Manual de Microbiologia de Água e Águas Residuais. Recuperado de cientedirect.com.
- Tasker, p.PARA. et al. (2003). Aplicações de química de coordenação. Extração de CuIi De soluções de cloreto. Na compreensão da química da coordenação. Recuperado de cientedirect.com.
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- « +125 ditos curtos e populares [com significado]
- 95 provérbios e disseram venezuelanos e seu significado »

