História do cloro, propriedades, estrutura, riscos, usa

- 1973
- 579
- Ralph Kohler
Ele cloro É um elemento químico que é representado pelo símbolo CL. É o segundo dos halogênios, localizado abaixo do flúor, sendo também o terceiro elemento mais eletronegativo de todos. Seu nome deriva de sua cor verde amarelada, que é mais intensa que a do flúor.
Popularmente quando alguém ouve seu nome, o que primeiro pensa está nos produtos de branqueamento para as roupas e na água das piscinas. Embora o cloro opere efetivamente nesses exemplos, não é o gás, mas seus compostos (especialmente hipocloritos) que exercem a ação descolorante e desinfetante.
 Balão redondo com cloro gasoso dentro. Fonte: Larenmclane [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]
Balão redondo com cloro gasoso dentro. Fonte: Larenmclane [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] Na imagem superior, um frasco redondo com cloro gasoso é mostrado. Sua densidade é maior que a do ar, o que explica por que permanece no balão e não escapa em direção à atmosfera; Como em outros gases mais leves, para dizer hélio ou nitrogênio. Nesse estado, é uma substância extremamente tóxica, pois produz ácido clorídrico nos pulmões.
É por isso que cloro elementar ou gasoso não tem muitos usos, mais do que em alguma síntese. No entanto, seus compostos, sejam sais ou moléculas orgânicas cloradas, cobrem um bom repertório de usos, colocando além das piscinas e roupas de extremo branco.
Além disso, seus átomos na forma de ânions de cloreto estão dentro de nossos corpos, regulando os níveis de sódio, cálcio e potássio, bem como em suco gástrico. Caso contrário, a ingestão de cloreto de sódio seria ainda mais letal.
O cloro ocorre através da eletrólise de salmoura, rica em cloreto de sódio, processo industrial no qual o hidróxido de sódio e hidrogênio também são obtidos. E como os mares são uma fonte quase inesgotável desse sal, as reservas potenciais desse elemento na hidrosfera são muito grandes.
[TOC]
História
Primeiros abordagens
Devido à alta reatividade do cloro gasoso, as civilizações antigas nunca suspeitaram de sua existência. No entanto, seus compostos faziam parte da cultura da humanidade do passado; Sua história começou a ser ligada ao sal comum.
Por outro lado, o cloro surgiu de erupções vulcânicas e quando alguém dissolveu ouro na água real; Mas nenhuma dessas primeiras abordagens foi suficiente para formular a ideia de que esse gás verde amarelado era um elemento composto.
Descoberta
A descoberta do cloro é atribuída ao químico sueco Carl Wilhelm Scheele, que em 1774 fez a reação entre o mineral de pirolusita e o ácido clorídrico (pelo então chamado ácido muriático).
Scheele fica com o crédito desde que foi o primeiro cientista a estudar as propriedades do cloro; Embora ele tenha sido reconhecido anteriormente (1630) por Jan Baptist Van Helmont.
Os experimentos com os quais Scheele obteve suas observações são interessantes: ele avaliou a ação de descoloração do cloro em flores avermelhadas e azuladas de flores, bem como nas folhas de plantas e insetos que morreram instantaneamente.
Ele também notificou seu alto reativo em relação aos metais, seu cheiro sufocante e efeito indesejável nos pulmões, e que quando ele se dissolveu na água, sua acidez aumentou.
Ácido oimuriático
Até então, os produtos químicos consideraram um ácido para todos os compostos que possuíam oxigênio; Então eles perderam o cloro deve ser um óxido gasoso. Foi para que eles chamassem de 'ácido oxiúático' (óxido de ácido muriático), nome cunhado pelo famoso químico francês Antoine Lavoisier.
Então, em 1809, Joseph Louis Gay-Lussac e Louis Jacques Thénard tentaram reduzir esse ácido carbono; reação obtida por metais de seus óxidos. Dessa forma, eles queriam extrair o elemento químico do suposto ácido oximuriático (que chamavam de 'ar deflístico do ácido muriático'.
No entanto, Gay-Lussac e Thénard falharam em seus experimentos; Mas eles foram bem -sucedidos ao considerar que o referido gás verde amarelado deve ser um elemento químico e não um composto.
Reconhecimento como elemento
O reconhecimento do cloro como elemento químico foi graças a Sir Humphry Davy, que em 1810 realizou seus próprios experimentos com eletrodos de carvão e concluiu que havia de fato um óxido de ácido muriático.
Além disso, foi Davy quem cunhou o nome 'cloro' para este elemento da palavra grega 'cloros', que significa amarelado.
Ao estudar as propriedades químicas do cloro, verificou -se que muitos de seus compostos tinham natureza salina; Portanto, eles o nomearam como um 'halogênio', o que significa formador de vendas. Então, o termo halogênio foi usado com os outros elementos do mesmo grupo (F, BR e I).
Michael Faraday até conseguiu Liquef2· H2QUALQUER.
Pode atendê -lo: carga nuclear eficazO restante da história do cloro está ligado às suas propriedades desinfetantes e de branqueamento, ao desenvolvimento do processo industrial de eletrólise de salão para produzir quantidades maciças de cloro.
Propriedades físicas e químicas
Aparência física
É um gás denso verde amarelado opaco, um cheiro irritante de hectare (uma versão super intensificada do cloro comercial) e também é extremamente venenoso.
Número atômico (Z)
17
Peso atômico
35,45 u.
Salvo indicação em contrário, o restante das propriedades corresponde a magnitudes medidas para cloro molecular, Cl2.
Ponto de ebulição
-34.04 ºC
Ponto de fusão
-101,5 ºC
Densidade
-Em condições normais, 3,2 g/l
-Apenas no ponto de ebulição, 1.5624 g/ml
Observe que o cloro líquido é aproximadamente cinco vezes mais que o seu gás. Além disso, a densidade de seu vapor é 2,49 vezes maior que o ar. É por isso que, na primeira imagem, o cloro não tende a escapar do balão redondo, pois ser mais denso do que o ar está localizado no fundo. Esse recurso ainda faz um gás mais perigoso.
Calor de fusão
6.406 kJ/mol
Calor de vaporização
20,41 KJ/mol
Capacidade de calor molar
33.95 J/(mol · k)
Solubilidade em água
1,46 g/100 ml a 0 ºC
Pressão de vapor
7,67 atm a 25 ºC. Essa pressão é relativamente baixa em comparação com a de outros gases.
Eletro-negatividade
3.16 na escala Pauling.
Energias de ionização
-Primeiro: 1251,2 KJ/mol
-Segundo: 2298 KJ/mol
-Terceiro: 3822 KJ/mol
Condutividade térmica
8.9 · 10-3 C/(M · K)
Isótopos
O cloro ocorre na natureza principalmente como dois isótopos: 35Cl, com uma abundância de 76%, e 37CL, com uma abundância de 24%. Assim, o peso atômico (35,45 u) é uma média das massas atômicas desses dois isótopos, com suas respectivas porcentagens de abundância.
Todos os radioisótopos de cloro são artificiais, entre os quais o 36CL como o mais estável, com meia -vida de 300.000 anos.
Números de oxidação
O cloro pode ter vários números ou estados de oxidação quando faz parte de um composto. Sendo um dos átomos mais eletronegativos da tabela periódica, geralmente possui números negativos de oxidação; Exceto quando corre com oxigênio ou flúor, em cujos óxidos e fluoretos, respectivamente, deve "perder" elétrons.
Em seus números de oxidação, a existência ou presença de íons com a mesma magnitude de carga é assumida. Assim, temos: -1 (cl-, O famoso ânion de cloreto), +1 (Cl+), +2 (Cl2+), +3 (Cl3+), +4 (Cl4+), +5 (Cl5+), +6 (Cl6+) e +7 (Cl7+). De tudo, os -1, +1, +3, +5 e +7 são os mais comuns encontrados em compostos clorados.
Para exemplos, no CLF e CLF3 Os números de oxidação do cloro são +1 (Cl+F-) e +3 (Cl3+F3-). No cl2Ou, isso é +1 (CL2+QUALQUER2-); Enquanto estiver no CLO2, Cl2QUALQUER3 e cl2QUALQUER7, Filho +4 (Cl4+QUALQUER22-), +3 (Cl23+QUALQUER32-) e +7 (Cl27+QUALQUER72-).
Em todos os cloretos, por outro lado, o cloro possui número de oxidação de -1; Como no caso de NaCl (NA+Cl-), Onde é válido dizer que o CL existe- Dada a natureza iônica deste sal.
Estrutura e configuração eletrônica
Molécula de cloro
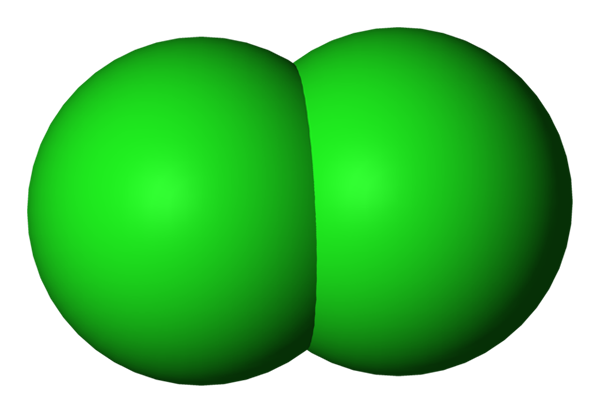 Molécula de cloro diatômica representada com um modelo de preenchimento de espaço. Fonte: Benjah-BMM27 via Wikipedia.
Molécula de cloro diatômica representada com um modelo de preenchimento de espaço. Fonte: Benjah-BMM27 via Wikipedia. Os átomos de cloro em seu estado basal têm a seguinte configuração eletrônica:
[NE] 3s2 3p5
Portanto, cada um deles tem sete elétrons de Valência. A menos que estejam sobrecarregados com energia, haverá átomos individuais no espaço, como se fossem mármores verdes. No entanto, sua tendência natural é formar laços covalentes entre eles, a fim de completar seus octetos de Valência.
Observe que eles mal precisam de um elétron para ter oito elétrons de valência, então formam um único link simples; É isso, aquele que se junta a dois átomos de CL para criar a molécula de Cl2 (Imagem superior), Cl-Cl. É por isso que o cloro em condições normais e/ou terrestres é um gás molecular; não -monoatômico, como é o caso com gases nobres.
Interações intermoleculares
A molécula cl2 É homonuclear e apolar, então suas interações intermoleculares são governadas pelas forças de dispersão de Londres e suas massas moleculares. Em uma fase de refrigerante, a distância cl2-Cl2 É relativamente curto em comparação com outros gases que, acrescentaram sua massa, o torna um gás três vezes mais que o ar.
A luz pode excitar e promover transições eletrônicas dentro dos orbitais moleculares do CL2; Consequentemente, sua característica cor verde amarelada aparece. Essa cor se intensifica no estado líquido e depois desaparece parcialmente quando solidifica.
Pode atendê -lo: bases fracasÀ medida que a temperatura desce (-34 ºC), as moléculas Cl2 Eles perdem energia cinética e a distância cl2-Cl2 diminui; Portanto, eles coesos e acabam definindo cloro líquido. O mesmo acontece quando o sistema (-101 ºC) é ainda mais resfriado, agora com as moléculas de Cl2 Então, juntos, que definem um cristal ortorrômbico.
O fato de haver cristais de cloro é indicativo de que suas forças dispersivas são suficientemente direcionais para criar um padrão estrutural; Esta é, camadas moleculares de CL2. A separação dessas camadas é tal que, mesmo sob uma pressão de 64 GPa, sua estrutura é modificada, nem exibem condutores elétricos.
Onde está e obtenha
Sais de cloreto
 Cristais robustos de Halita, mais conhecidos como com comum ou sal de mesa. Fonte: Parent Géry [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]
Cristais robustos de Halita, mais conhecidos como com comum ou sal de mesa. Fonte: Parent Géry [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] O cloro em seu estado gasoso não pode ser encontrado em nenhum lugar na superfície da terra, pois é muito reativo e tende a formar cloretos. Esses cloretos estão bem espalhados por toda a crosta terrestre e, além disso, depois de milhões de anos sendo arrastados pelas chuvas, os mares e os oceanos estão enriquecendo.
Entre todos os cloretos, a halita mineral de NaCl del (imagem superior) é a mais comum e abundante; seguido pela Silvina, KCL e Carnalita, MGCL Minerals2· KCl · 6h2QUALQUER. Quando as massas de água evaporam pela ação do sol, deixa para trás os lagos de sal do deserto, dos quais a NaCl pode ser extraída diretamente como matéria -prima para cloro.
Eletrólise de salmoura
A NaCl se dissolve em água para produzir uma salmoura (26%), na qual a eletrólise é submetida em uma célula de cloralcalina. Lá, duas semi -reações ocorrem nos compartimentos de ânodo e cátodo:
2cl-(AC) => Cl2(g) + 2e- (Ânodo)
2h2Ou (l) + 2e- => 2oh-(AC) + H2(g) (cátodo)
E a equação global para ambas as reações é:
2NACL (AC) + 2H2Ou (l) => 2naoh (ac) + h2(g) + cl2(g)
À medida que a reação ocorre, os íons Na+ formado no ânodo que eles migram para o compartimento do cátodo cruzando uma membrana permeável ao amianto. Por esse motivo, o NaOH está do lado direito da equação global. Ambos os gases, CL2 e h2, Eles são coletados do ânodo e cátodo, respectivamente.
A imagem inferior ilustra o novo escrito:
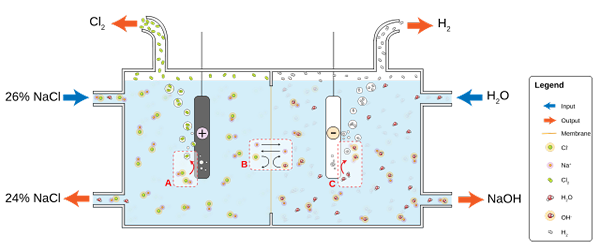 Diagrama para produção de cloro através de eletrólise de salmoura. Fonte: JKWCHUI [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]
Diagrama para produção de cloro através de eletrólise de salmoura. Fonte: JKWCHUI [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] Observe que a concentração da salmoura no final diminui em 2% (é de 24 a 26%), o que significa que parte de seu CL- Originais transformados em moléculas de CL2. No final, a industrialização desse processo concedeu um método para produzir cloro, hidrogênio e hidróxido de sódio.
Dissolução ácida da pirolusita
Como mencionado na seção de história, o cloro gasoso pode ser produzido dissolvendo amostras de minério de pirolusita com ácido clorídrico. A equação química a seguir mostra os produtos obtidos da reação:
Mne2(S) + 4HCl (AC) => MCL2(AC) + 2h2Ou (l) + cl2(g)
Ligas
Não há ligas de cloro por duas razões simples: suas moléculas gasosas não podem ser presas entre os cristais de metal, e estes também são muito reativos, para que reagiriam imediatamente com metais para produzir seu respectivo cloreto.
Por outro lado, os cloretos também não são desejáveis, porque uma vez dissolvidos na água eles exercem um efeito salino que promove a corrosão em ligas; E, portanto, os metais se dissolvem para formar cloretos de metal. O processo de corrosão para cada liga é diferente; Alguns são mais suscetíveis do que outros.
O cloro, consequentemente, não é um bom aditivo para ligas; nem como cl2 nem como cl- (E os átomos seriam muito reativos para que possam até existir).
Riscos
Embora a solubilidade do cloro na água seja baixa, é suficiente para produzir na umidade de nossa pele e olhos, o ácido clorídrico, que acaba corroendo os tecidos causando irritações graves e até a perda de visão.
Pior ainda é respirar seus vapores esverdeados amarelados, já que uma vez nos pulmões o gera novamente ácidos e danifica o tecido pulmonar. Com isso, a pessoa experimenta dor na garganta, tosse e dificuldades respiratórias por causa dos fluidos formados nos pulmões.
Se houver uma fuga de cloro, está enfrentando uma situação particularmente perigosa: o ar não pode simplesmente "varrer" seus vapores; Fique lá até que eles reagam ou dispersem lentamente.
Pode atendê -lo: equilíbrio de precisão: características, funções, peças, usosAlém disso, é um composto altamente oxidante; portanto, várias substâncias podem reagir explosivamente com ele ao menor contato; Assim como a lã de aço e alumínio. É por isso que onde há um cloro armazenado, todas as considerações necessárias devem ser tomadas para evitar riscos de incêndio.
Ironicamente, enquanto o cloro gasoso é mortal, seu ânion de cloreto não é tóxico; Pode ser consumido (com moderação), não queima ou reage, exceto com fluoreto e outros reagentes.
Formulários
Síntese
Cerca de 81 % do cloro gasoso produzido anualmente é destinado à síntese de cloretos orgânicos e inorgânicos. Dependendo do grau de covalência desses compostos, o cloro pode ser encontrado como meros átomos de CL em moléculas orgânicas cloradas (com ligações C-Cl) ou como íons cl- Em alguns sais de cloreto (NaCl, CACL2, Mgcl2, etc.).
Cada um desses compostos tem suas próprias aplicações. Por exemplo, clorofórmio (CHCL3) e cloreto de etila (CH3CH2Cl) são solventes que passaram a ser usados como anestésicos de inalação; O diclorometano (CH2Cl2) e tetracloreto de carbono (CCL4), Por sua parte, eles são solventes amplamente utilizados em laboratórios de química orgânica.
Quando esses compostos clorados são líquidos, na maioria das vezes são destinados a solventes para reações orgânicas significa.
Em outros compostos, a presença de átomos de cloro representa um aumento no momento dipolar, para que eles possam interagir em maior grau com uma matriz polar; A formado por proteínas, aminoácidos, ácidos nucleicos, etc., Biomoléculas. Assim, o cloro também possui papel na síntese de medicamentos, pesticidas, inseticidas, fungicidas, etc.
Em relação aos cloretos inorgânicos, eles geralmente são usados como catalisadores, matéria -prima para obter metais por eletrólise ou fontes de íons cl-.
Biológico
Cloro gasoso ou elementar não tem papel nos seres vivos mais do que destruir seus tecidos. No entanto, isso não significa que seus átomos não possam ser encontrados no corpo. Por exemplo, íons cl- Eles são muito abundantes no meio celular e extracelular e ajudam a controlar os níveis de íons Na+ e ca2+, em sua maioria.
Da mesma forma, o ácido clorídrico faz parte do suco gástrico com o qual os alimentos são digeridos no estômago; seus íons cl-, Na companhia de H3QUALQUER+, Defina o pH próximo a 1 dessas secreções.
Armas quimicas
A densidade do cloro gasoso o torna uma substância letal quando é derramada ou derramada em espaços fechados ou abertos. Sendo mais denso que o ar, uma corrente não arrasta facilmente o cloro, por isso permanece por um tempo considerável antes de finalmente se dispersar.
Na Primeira Guerra Mundial, por exemplo, este cloro foi usado em campos de batalha. Uma vez liberado, ele entrou nas trincheiras para sufocar os soldados e forçá -los a ir à superfície.
Desinfetante
 As piscinas são cloronizadas para evitar a reprodução e a disseminação de microorganismos. Fonte: Pixabay.
As piscinas são cloronizadas para evitar a reprodução e a disseminação de microorganismos. Fonte: Pixabay. As soluções cloronizadas, aquelas em que o cloro gasoso foram dissolvidas em água e depois serem alcaladas com um tampão, têm excelentes propriedades desinfetantes, além de inibir a podridão dos tecidos. Eles foram usados para desinfetar feridas abertas para eliminar bactérias patogênicas.
A água da piscina é cloronizada com precisão para eliminar bactérias, micróbios e parasitas que podem abrigá -lo. Para esse fim, o cloro gasoso costumava ser usado, no entanto, sua ação é bastante agressiva. Em vez disso, são usadas soluções de hipoclorito de sódio (alvejante) ou ácido tricloroisocianúrico (ATC) (ATC).
O exposto mostra que não é o CL2 Aquele que exerce a ação desinfetante, mas o HCLO, o ácido hipoclorito, que produz radicais ou · que destroem microorganismos.
Água sanitária
Muito semelhante à sua ação desinfetante, o cloro também bate os materiais porque as cores responsáveis pelo HCLO. Assim, suas soluções cloronizadas são ideais para remover as manchas de roupas brancas ou para a polpa de papel alvejante.
Polivinilcloreto
O composto clorado mais importante de todos, para o qual cerca de 19% da produção restante de cloro gasoso é alocada, é o policloreto de vinil (PVC). Este plástico tem vários usos. Com ele, os tubos de água são feitos, as molduras das janelas, paredes de paredes e pisos, fiação elétrica, sacolas intravenosas, casacos, etc.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2019). Cloro. Recuperado de: em.Wikipedia.org
- Laura h. et al. (2018). Estrutura de cloro sólido em 1.45 gpazeitschrift für kristallgraphie. Materiais cristalinos, volume 234, edição 4, páginas 277-280, ISSN (Online) 2196-7105, ISSN (Print) 2194-4946, doi: doi.org/10.1515/ZKRI-2018-2145
- Centro Nacional de Informações sobre Biotecnologia. (2019). Cloro. Banco de dados PubChem. CID = 24526. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Marques Miguel. (s.F.). Cloro. Recuperado de: Nautilus.Fis.Uc.Pt
- Conselho de Química Americana. (2019). Química de cloro: Introdução ao cloro. Recuperado de: cloro.AmeriCachemistry.com
- Fong-yan ma. (s.F.). Efeitos corrosivos de cloretos em metais. Departamento de Engenharia Marinha, República da NOU da China (Taiwan).
- Estado de Nova Iorque. (2019). Os fatos sobre cloro. Recuperado de: saúde.Nova Iorque.Gov
- Dr. Doug Stewart. (2019). Fatos do elemento de cloro. Chemicool. Recuperado de: Chemicool.com

