Características da cisteína, estrutura, funções, biossíntese
- 2905
- 328
- Terrence King IV
O Cisteína (Cys, c) é um dos 22 aminoácidos encontrados na natureza como parte das cadeias polipeptídicas que compõem as proteínas dos seres vivos. É essencial para a estabilidade das estruturas terciárias das proteínas, pois ajuda a formação de pontes de dissulfeto intramolecular.
Além disso, é verdade para outros aminoácidos como alanina, arginina, asparagina, glutamato e glutamina, glicina, prolina, serina e tirosina, os seres humanos são capazes de sintetizar a cisteína, portanto isso não é considerado como um aminoácido essencial.
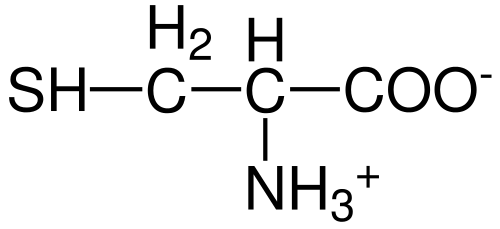
 Estrutura de aminoácidos de cisteína (Fonte: Hattrich [Domínio Público] via Wikimedia Commons)
Estrutura de aminoácidos de cisteína (Fonte: Hattrich [Domínio Público] via Wikimedia Commons) Apesar disso, e tendo em vista o fato de que as taxas de síntese nem sempre fornecem requisitos do corpo, alguns autores descrevem a cisteína como um aminoácido "condicionalmente" essencialmente ".
Este aminoácido foi nomeado pela "Cystina", um componente dos cálculos vesiculares descobertos em 1810, cujo nome foi cunhado em 1832 por um. Baudrimont e f. Malaguti. Alguns anos depois, em 1884, e. Baumann descobriu que a cisteína era o produto da redução de cistina.
Após o trabalho realizado por Bauman, em 1899, foi determinado que a cisteína é o principal constituinte da proteína que forma os chifres de vários animais, o que sugeriu seu possível uso para a síntese de polipeptídeos.
Atualmente, sabe -se que a cisteína corporal vem de alimentos, reciclagem de proteínas e síntese endógena, que ocorre principalmente em hepatócitos.
[TOC]
Caracteristicas
A cisteína tem um peso molecular de 121.16 g/mol e é encontrado, juntamente com leucina, isoleucina, valina, fenilalanina, triptofano, metionina e tirosina, entre os aminoácidos mais hidrofóbicos.
Pertence ao grupo de aminoácidos polares sem carga e, como outros aminoácidos, pode ser degradado pela hidrólise alcalina a altas temperaturas.
Como o triptofano, serina, glicina e treonina, a cisteína é um precursor metabólico da gluconeogênese e cetogênese (formação de corpos de cetona).
Este aminoácido existe como parte da sequência peptídica de proteínas, mas também pode ser livre no plasma sanguíneo como dissulfetos homogêneos (cistina, um derivado) ou misturados, compostos da forma de homocisteína-cisteína-cisteína.
A principal diferença entre cisteína livre e a encontrada na estrutura da proteína é que a primeira está em um estado redox muito enferrujado, enquanto a última é geralmente bastante reduzida.
Estrutura
Como no restante dos aminoácidos descritos até o momento, a cisteína tem um átomo de carbono central, que é quiral e conhecido como carbono α.
Quatro espécies químicas diferentes são unidas a este átomo de carbono:
- Um grupo amino (-NH3+)
- Um grupo carboxila (-co-)
- um átomo de hidrogênio e
- Um substituinte (-r).
O grupo substituinte é aquele que dá identidade a cada aminoácido e o da cisteína é caracterizado por contendo um átomo de enxofre como parte de um grupo Tiol qualquer Sulfidrillo (-Ch2-sh).

É esse grupo que permite participar da formação de pontes de dissulfeto intra-inter-intermolecular. Como é um nucleófilo, você também pode participar de reações de substituição.
De fato, esta cadeia lateral da cisteína pode ser modificada para a formação de dois compostos conhecidos como "selenocisteína" e "Lantenina". O primeiro é um aminoácido que também participa da formação de proteínas e o segundo é um derivado de aminoácidos não -proteínas.
Pode atendê -lo: histonas: características, estrutura, tipos e funçõesO grupo cisteína Tiol também é caracterizado por sua grande afinidade com os íons de prata e mercúrio (Ag+ e Hg2+).
Funções
As principais funções de cisteína nos organismos vivos têm a ver com sua participação na formação de proteínas. Especificamente, a cisteína participa do estabelecimento de pontes dissulfeto, essenciais para a formação da estrutura da proteína terciária.
Além disso, esse aminoácido não é apenas útil para a síntese de proteínas, mas também participa da síntese de glutationa (GSH) e fornece enxofre reduzido para metionina, ácido lipóico, tiamina, coenzima A (COA), molibdopterina (um cofactor) e outro compostos com importância biológica.
Sob condições de quantidade excessiva de aminoácidos sulfurizados, a cisteína e outros aminoácidos relacionados podem ser usados para a produção de piruvato inorgânico e enxofre. O piruvato consegue ser redirecionado em direção à rota gluconeogênica, servindo para a produção de glicose.
As queratinas, que são um dos tipos mais abundantes de proteínas estruturais do reino animal, são ricos em resíduos de cisteína. Por exemplo, lã de ovelha contém mais de 4% de enxofre deste aminoácido.
A cisteína também participa de muitas reações de redução de óxido, por isso faz parte do local ativo de algumas enzimas.
Ao reagir com glicose, este aminoácido gera produtos de reação que introduzem gostos e aromas atraentes para algumas preparações culinárias.
Biossíntese
A biossíntese de aminoácidos no corpo humano e no de outros animais (mamíferos e não mamíferos) ocorre em uma forma de tecido e na classe celular; É um processo que merece energia e geralmente é separado entre diferentes órgãos.
O fígado é um dos principais órgãos envolvidos na síntese da maioria dos aminoácidos não essenciais, independentemente das espécies consideradas.
Nisso, não apenas a cisteína é sintetizada, mas também aspartato, asparagina, glutamato e glutamina, glicina, serina, tirosina e outros de seus precursores específicos de aminoácidos.
Em 1935, a marca Erwin determinou que a cisteína, em mamíferos, é naturalmente sintetizada a partir da metionina, que ocorre exclusivamente em tecido hepático.
Esse processo pode ocorrer devido a um "transmétil" da metionina, onde os grupos metil são transferidos para a colina e a creatina. No entanto, a cisteína também pode ser formada a partir de metionina graças a uma repartição.
Posteriormente, foi demonstrado que, além da metionina, alguns compostos sintéticos, como N-acetil cisteína, cisteamina e cistamina, são precursores úteis para síntese de cisteína.
No caso da N-acetil cisteína, isso é levado pelas células, onde é convertido em cisteína por uma enzima do citosol no citosol.
Mecanismo de síntese
O mecanismo de síntese de cisteína da métodina mais conhecida é o de trans -ílulo. Isso ocorre principalmente no fígado, mas também foi determinado no intestino e no pâncreas.
Isso ocorre da homocisteína, um composto derivado da métodina de aminoácidos; E a primeira reação desta rota biossintética é uma condensação catalisada pela enzima cistacionina da β-sentase (CBS) (CBS) (CBS).
Pode servir a você: Uracil: estrutura, funções, propriedades, sínteseEsta enzima representa a passagem do "compromisso" da rota e condensa uma homocisteína com um resíduo de serina, outro aminoácido de proteína, que produz cistacionina. Posteriormente, este composto é "cortado" ou "dividido" pela enzima Cistationasa, o que leva à liberação de cisteína.
A regulação da atividade enzimática da CBS é mediada pela disponibilidade de métodina e pelo estado redox da célula onde esse processo ocorre.
Através da rota de síntese de cisteína, as células podem lidar com o excesso de métodina, pois sua conversão em cisteína é um processo irreversível.
Síntese de cisteína em plantas e microorganismos
Nesses organismos, a cisteína é sintetizada principalmente do enxofre inorgânico, que é a fonte mais abundante de enxofre utilizável na biosfera aeróbica.
Isso é tomado, entra nas células e é então reduzido ao sulfeto (S2-), que é incorporado à cisteína de maneira semelhante ao que acontece com o amônio na síntese de glutamato ou glutamina.
Metabolismo e degradação
O catabolismo cisteína ocorre principalmente em células hepáticas (hepatócitos), embora também possa ocorrer em outros tipos de células como neurônios, células endoteliais e células musculares lisas do corpo da vasculatura do corpo.
Certos defeitos no catabolismo da cisteína produzem uma doença hereditária conhecida como "cistinúria", caracterizada pela presença de cálculos de cistina nos rins, bexiga e ureter.
A cistina é um aminoácido derivado da cisteína e os cálculos são formados pela união de duas moléculas através de seus átomos de enxofre.
Parte do metabolismo da cisteína resulta na formação de ácido científico, a partir do qual é formado um tourado, um aminoácido não proteico é formado. A reação é catalisada pela enzima cisteína Dioxigenasa.
Além disso, a cisteína pode ser oxidada pelo formaldeído para produzir cisteína N-formil, cujo processamento subsequente pode levar à formação de "mercadorias" (produto da condensação de cisteínas com compostos aromáticos).
Nos animais, também é utilizada cisteína, bem como glutamato e glutamina, para a síntese da coenzima A, glutationa (GSH), piruvato, sulfato e ácido sulfiderico.
Um dos métodos para conversão de cisteína em piruvato ocorre em duas etapas: a primeira implica a remoção do átomo de enxofre e a segunda reação de transaminação.
Os rins são responsáveis pela excreção de sulfatos e sulfitos derivados do metabolismo de compostos de enxofre, como a cisteína, enquanto os pulmões exalam dióxido de enxofre e ácido sulfidrico.
Glutation
A glutationa, uma molécula formada por três resíduos de aminoácidos (glicina, glutamato e cisteína) é uma molécula presente em plantas, animais e bactérias.
Possui propriedades especiais que o tornam um excelente "tampão" redox, pois protege as células de diferentes tipos de estresse oxidativo.
Alimentos ricos em cisteína
A cisteína é naturalmente encontrada em alimentos que contêm enxofre como as gemas (amarelas) de ovos, pimentas vermelhas, alho, cebola, brócolis, couve -flor, coliflower, Collils e Bruxelas Chóis, Clakes Water -Clakes e Mostarda.
Também está presente principalmente em alimentos ricos em proteínas, como carnes, legumes e laticínios, entre os quais estão:
Pode atendê -lo: Ovalbumin: estrutura, funções, desnaturação- Carne de vaca, carne de porco, frango e peixe
- Aveia e lentilhas
- Sementes de girassol
- Iogurte e queijo
Benefícios da ingestão de cisteína
Considera -se que sua ingestão impede a perda de cabelo e estimula seu crescimento. Na indústria de alimentos, é muito utilizado como um agente de massagem panificável e também para "reproduzir" os sabores semelhantes à carne.
Outros autores enfatizaram que a ingestão de suplementos alimentares ou alimentos ricos em alimentos diminui.
Alguns suplementos nutricionais relacionados à cisteína são usados por seres humanos como antioxidantes, o que é considerado benéfico do ponto de vista do "atraso" do envelhecimento.
O N-acetil cisteína (um precursor na síntese da cisteína), por exemplo, é tomado como um suplemento nutricional, pois isso resulta em um aumento na biossíntese de glutationa (GSH).
Doenças relacionadas
Existem algumas publicações científicas que relacionam altos níveis de cisteína plasmática com obesidade e outras patologias relacionadas, como doenças cardiovasculares e outras síndromes metabólicas.
A cistinúria, como mencionado acima, é uma patologia relacionada à presença de pedras de cistina, um derivado de Zip, devido a um defeito genético na reabsorção dos aminoácidos dibasicos, como a cistina.
Distúrbios de deficiência
A deficiência de cisteína tem sido relacionada ao estresse oxidativo, pois esse é um dos principais precursores da síntese de glutationa. Portanto, deficiências neste aminoácido podem levar ao envelhecimento prematuro e a todos os apartamentos que isso significa.
Foi demonstrado experimentalmente que a suplementação de cisteína melhora as funções do músculo esquelético, diminui a relação entre a gordura e a massa corporal não -gordura, diminui os níveis plasmáticos de citocinas inflamatórias, melhora as funções do sistema imunológico etc.
Em meados da década de 1990, alguns estudos sugeriram que a síndrome da imunodeficiência adquirida (AIDS) poderia ser uma conseqüência de uma deficiência de cisteína induzida por vírus.
Essas declarações foram apoiadas pelo fato de que pacientes hi-positivos examinados apresentaram baixos níveis de cistina plasmática e cisteína, além de concentrações intracelulares reduzidas de glutationa.
Referências
- Dröge, w. (1993). Deficiência de cisteína e glutationa em pacientes com AIDS: uma justificativa para tratamento com n-acicil-cisteína. Farmacologia, 46, 61-65.
- Dröge, w. (2005). Estresse oxidativo e envelhecimento: está envelhecendo uma síndrome de deficiedade de cisteína? Transações filosóficas da Royal Society B: Ciências Biológicas, 360(1464), 2355-2372.
- Elshorbagy, a. K., Smith, a. D., Kozich, v., & Refsum, H. (2011). Cisteína e obesidade. Obesidade, vinte(3), 1-9.
- Kridich, n. (2013). Biossíntese de cisteína. Ecosal Plus, 1-30.
- McPherson, r. PARA., & Hardy, g. (2011). Benefícios clínicos e nutricionais de suplementos de proteína enriquecida com cisteína. Opinião atual em nutrição clínica e cuidados metabólicos, 14, 562-568.
- Mokhtari, v., Afsharian, p., Shahhoseini, m., Kalantar, s. M., & Moini, um. (2017). Uma revisão sobre vários usos de N-acetil cisteína. Cell Journal, 19(1), 11-17.
- Pista, p. (2013). Antioxidante de cisteína-mestre. Jornal Internacional de Ciências Farmacêuticas, Químicas e Biológicas, 3(1), 143-149.
- Quig, d. (1998). Metabolismo de cisteína e toxicidade de metal. Revisão de Medicina Alternativa, 3(4), 262-270.
- Wu, g. (2013). Amininoácidos. Bioquímica e nutrição. Boca Raton, FL: Grupo Taylor & Francis.
- « Características de aprendizado social, teoria de Bandura, exemplos
- Dimensões da educação emimocional »

