Enzima cinética
- 5029
- 69
- Dennis Heidenreich
O que é cinética enzimática?
O Enzima cinética É um campo de estudo em que a físico -química e a bioquímica se encontram para estudar reações químicas catalisadas por enzimas. As enzimas são catalisadores biológicos que aumentam a velocidade de uma reação química diminuindo sua energia de ativação.
Enzimas catalisam as reações químicas de grande importância para a manutenção da vida. Eles têm um pH e uma temperatura ideal para exercer sua ação catalítica no substrato, por isso são fatores essenciais no estudo de suas atividades.
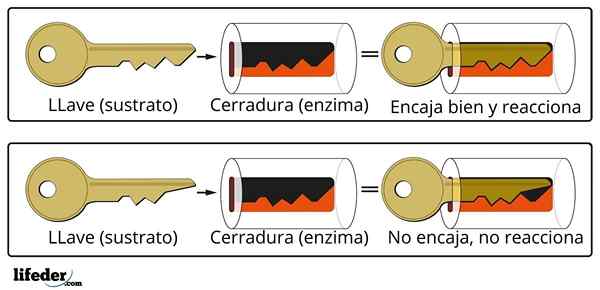
 O sistema de fechamento-chave é uma analogia aproximada ao sistema de substrato-enzima.
O sistema de fechamento-chave é uma analogia aproximada ao sistema de substrato-enzima. A enzima interage com o substrato através de uma região especializada de sua cadeia proteica, que é chamada de centro ativo, cuja estrutura tridimensional é acoplada à estrutura do substrato. A interação entre o centro ativo e o substrato é geralmente fraca e não é covalente.
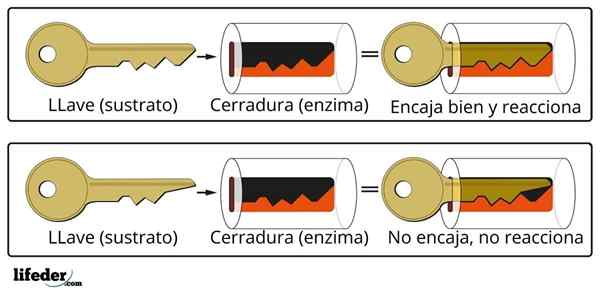
O número de centros de enzimas ativos é limitado, produzindo sua saturação com moléculas de substrato, o que, por sua vez, impede que a velocidade da reação aumente além de um certo valor, conhecido como velocidade máxima.
A cinética enzimática não apenas combina bioquímica e físico -química, mas também química bioinorgânica, supramolecular, química computacional e estatística.
Entre os modelos que o descrevem, é o de Michaelis -Menc. Hoje ainda é um dos modelos que são mais usados para descrever a cinética enzimática.
Conceitos básicos na cinética enzimática
Catálise enzimática
As enzimas são proteínas, com atividades catalíticas, capazes de agir em uma molécula chamada substrato, catalisando sua transformação em outra substância conhecida como produto. As enzimas não são consumidas durante sua ação catalítica, permanecendo sua massa constante.
Atividade catalítica
A atividade catalítica da enzima é realizada em uma estrutura tridimensional especializada, conhecida como centro ativo. Isso é formado pela dobra da cadeia de proteínas enzimáticas que determina a interação de um grupo de aminoácidos que formam o centro ativo.
Centro ativo
O centro ativo não é uma estrutura rígida, mas capaz de se adaptar geometricamente ao substrato para interagir com ele. A interação é geralmente fraca (forças de van der Waals), embora haja enzimas que formam um elo covalente com o substrato.
Pode servir a você: gordura butírica: obtenção, tipos, composição, usos, benefíciosDiminuição da energia de ativação
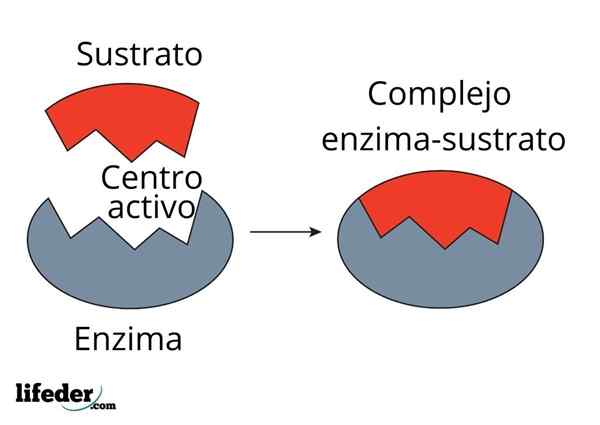
 A enzima carbônica de anidrase diminui a energia de ativação para a conversão de CO2 para H2CO3. Fonte: Fvasconcellos (Talk • Contribs), CC BY-SA 3.0, via Wikimedia Commons
A enzima carbônica de anidrase diminui a energia de ativação para a conversão de CO2 para H2CO3. Fonte: Fvasconcellos (Talk • Contribs), CC BY-SA 3.0, via Wikimedia Commons As enzimas catalisam as reações que diminuem a energia de ativação e, portanto, também reduzindo o consumo de energia livre (g) para a conclusão do processo catalisado. As enzimas não modificam o ponto de equilíbrio das reações químicas não catalisadas.
Observe como a enzima de anidrase carbônica diminui a energia de ativação para co -conversão2 para h2Co3. Embora a distância entre o vermelho e a linha azulada não pareça muito, essa enzima aumenta a velocidade da ordem de milhões de vezes (106), comparado à reação realizada sem a participação deles.
Especificidade de esterees
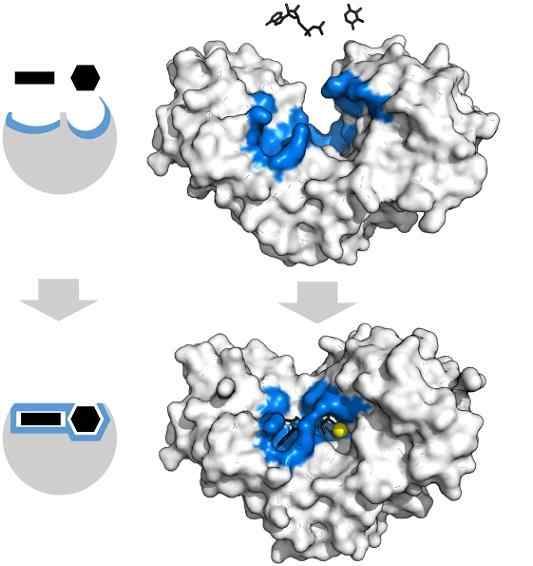 Os substratos de adenosina trifosfato e xilose têm a forma específica que coincide com a geometria do centro ativo da enzima da hexoquinase. Fonte: Thomas Shafee, CC por 4.0, via Wikimedia Commons
Os substratos de adenosina trifosfato e xilose têm a forma específica que coincide com a geometria do centro ativo da enzima da hexoquinase. Fonte: Thomas Shafee, CC por 4.0, via Wikimedia Commons As enzimas, em geral, são altamente específicas para as reações que catalisam, uma vez que as moléculas de substrato devem interagir com o centro ativo que apresenta um conjunto de requisitos para o seu acoplamento com ele.
Assim, por exemplo, o centro ativo da hexoquinase, que é dinâmico devido às vibrações moleculares das cadeias de proteínas, oferece grupos em orientações espaciais exatas, de modo que as moléculas de adenosina e xilosina adenosina, como se fossem peças geométricas geométricas.
A menor perturbação física ou química, e a região azul -hexoquinase não pode mais acomodar os substratos.
Velocidade máxima
As enzimas têm um número limitado de centros ativos, portanto, aumentando a concentração de substrato. Isso determina que a velocidade da reação catalisada não pode aumentar além de um certo valor, conhecido como velocidade máxima.
Sensibilidade à temperatura e pH
A atividade catalítica enzimática depende da temperatura e do pH, tendo valores ideais desses parâmetros para sua operação. Da mesma forma, porque são as moléculas de proteína enzimes, elas são suscetíveis a uma desnaturação química ou térmica.
Cofatores
Algumas enzimas aumentam sua atividade catalítica devido à influência de certos fatores, que podem ser metais ou compostos orgânicos conhecidos como coenzimas.
Da mesma forma, as enzimas podem ser inibidas competitivas e não -competitivas. No caso da hexoquinase de cima, o MG2+ (esfera amarela) atua como um cofator.
Taxa de reação enzimática
A velocidade de uma reação enzimática depende da concentração de substrato e concentração enzimática. Quando a concentração de substrato é baixa, há uma relação quase linear entre velocidade enzimática e concentração de substrato.
Pode servir a você: sem metais: história, propriedades, grupos, usosPortanto, a velocidade enzimática aumenta na proporção direta à concentração de substrato; Mas, aumentando a concentração de substrato para um valor que satura os locais ativos da enzima, a velocidade máxima é atingida.
Uma vez que a velocidade enzimática ocorre, torna -se constante, ou seja, é independente da concentração de substrato e diz -se que a velocidade enzimática é zero. Além disso, a velocidade enzimática catalítica é proporcional à concentração do complexo enzimático-substrato [IS].
Como mostra a expressão matemática:
V = k2[É]
A velocidade máxima é diretamente proporcional à concentração total da enzima, como aparece na seguinte fórmula:
VMáx = KGatoEt
KGato É o número de rotação ou substituição e representa o número de moléculas de substrato que cada local enzimático converte em um produto por unidade de tempo. Enquantot representa o número de locais enzimáticos catalíticos. Simt Tem um valor alto, é necessário mais [s] para saturar os sites ou centros ativos.
Michaelis -Mente
Modelo
O modelo Mihaelis -Mente é baseado na ação das enzimas que atuam em um substrato simples e não são aplicáveis às enzimas alostéticas; isto é, aqueles que têm uma região regulatória da atividade catalítica do local ativo.
As enzimas a uma baixa concentração de substrato, têm uma atividade catalítica linear com a concentração de substrato; Mas em altas concentrações de substrato, a atividade catalítica é independente da concentração de substrato.
Em 1913, Leonor Michelis e Maud mencionaram propuseram um modelo para explicar o comportamento enzimático indicado, a existência de um complexo intermediário enzimático-sustrato [está] sendo importante no modelo [é].
Equação geral
A relação desse complexo com os outros componentes do processo enzimático, bem como com as constantes (k) que as relaciona, são indicadas no seguinte esquema:
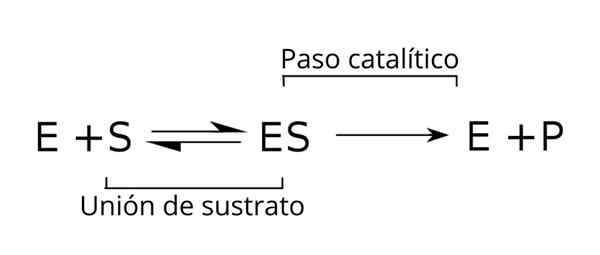 Equação geral dos substratos, o complexo enzimático-substrato e os produtos da cinética enzimática. Fonte: Tim Vickers via Wikipedia.
Equação geral dos substratos, o complexo enzimático-substrato e os produtos da cinética enzimática. Fonte: Tim Vickers via Wikipedia. A enzima (E) é combinada com o (s) substrato (s) para formar o complexo enzimático-substrato com uma constante de velocidade K1. O complexo E-S pode se dissociar em E e S com uma velocidade de reação constante K-1.
Da mesma forma, o complexo pode causar um produto (P) e a separação da enzima, que pode ser reciclada para atender a outro ciclo de atividade enzimática. Uma situação de equilíbrio pode ser alcançada para o estado [é] em que sua velocidade de formação é igual à sua velocidade de decomposição.
Pode atendê -lo: elementos químicos naturaisK1[É] [s] = (k-1 + K2) [É] (1)
REGULHAR TERMOS E LEMBRAÇÃO [IS], você tem:
[É] = ([e] [s]) / (k-1 + K2 / K1) (2)
KM = (K-1 + K2) / K1
KM É uma constante introduzida por Michaelis.
Termos da equação Michaelis -Mente
Substituindo agora kM Em (2) continuamos:
[É] = [e] [s] / kM (3)
A concentração de enzima não combinada é:
[E] = [eT] - [es] (4)
Onde [e] é a enzima livre e [eT] A concentração total da enzima.
Combinando as equações 3 e 4, fazendo as substituições devidas e também levando em consideração VMáx, A equação de Michaelis-Muene é alcançada, expressa da seguinte maneira:
V = (vMáx [S]) / ([s] + kM)
A velocidade máxima da reação enzimática ocorre quando a concentração de substrato é muito maior que kM E os locais catalíticos das enzimas são saturados com substrato. Isso ocorre quando o relacionamento (s]/[s] + kM Abordagens para 1.
Quando [s] é igual a kM, A parte da equação [s] / [s] + kM é igual a 1/2, indicando que kM É a concentração de substrato que produz uma taxa de reação enzimática que é metade da velocidade máxima.
Além disso, kM É uma medida da afinidade de uma enzima pelo substrato: quanto maior o valor do kM, Menor será a afinidade da enzima para o substrato e vice -versa. Portanto, para um kM alta a velocidade da reação enzimática será baixa.
Gráfico Lineweaver-Burk
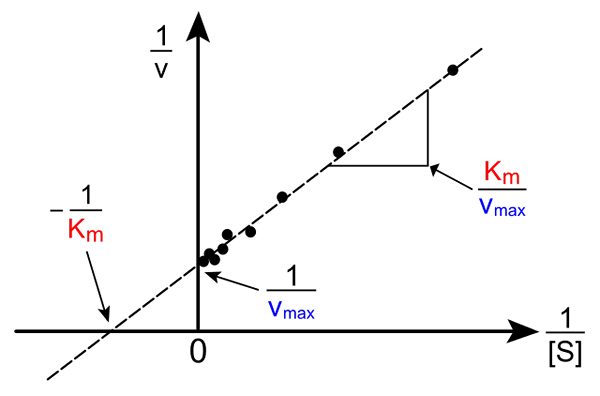 Lineweaver-Burk reto. Fonte: Pro Bug Catcher via Wikipedia.
Lineweaver-Burk reto. Fonte: Pro Bug Catcher via Wikipedia. A transformação da equação de Michaelis-Mune para produzir sua forma inversa tem a seguinte forma:
1/v = (kM / VMáx) (1 / [s]) + 1 / vMáx
A importância desta linha é que ela tem uma interseção com o eixo x em - 1/kM, e com o eixo y em y = 1/vMáx (Imagem superior). A linha tem uma inclinação de kM/Vmax. Isso permite informações sobre VMáx e kM Graphing o inverso das velocidades, dependendo do inverso das concentrações de substrato.
Referências
- Strayer, l. (1975). Bioquímica. 2dá Edição. Editorial revertido.
- Irã. Levine. (2009). Princípios da físico -química. Sexta edição. Mc Graw Hill.
- Wikipedia. (2020). Cinética enzimática. Recuperado de: em.Wikipedia.org
- Michael Blaber. (5 de junho de 2019). Cinética enzimática. Biologia Librettexts. Recuperado de: biografia.Librettexts.org
- Os editores da Enyclopaedia Britannica. (2020). Michaelis-Muen Kinetics. Recuperado de: Britannica.com
- Berg JM, Tymoczko JL, Stryer L. Bioquímica. 5ª edição. Nova York: W H Freeman; (2002). Seção 8.4: O modelo Michaelis é responsável pelas propriedades cinéticas de muitas enzimas. Recuperado de: NCBI.Nlm.NIH.Gov

