Ácidos e bases diferenças, características, exemplos
- 4284
- 459
- Terrence King IV
O ácidos e bases São compostos químicos que não apresentam uma única definição, mas vários, que dependem das características ou propriedades levadas em consideração. Em termos gerais, pode -se dizer que os ácidos são substâncias azedas, enquanto as bases são saponáceas ou sabonetes.
As definições mais importantes, como Brönsted-Lowry, ou Arrhenius, se concentram mais no lançamento de íons h3QUALQUER+ (Hydronium) u Oh-(hidroxila) por essas substâncias. Em suas formas puras ou dissolvidas na água.
Uma definição que surge como conseqüência do exposto é o seguinte: os ácidos dissolvidos em água geram soluções com valores de pH menores que 7, enquanto as bases dissolvidas produzem soluções com valores de pH maiores que 7. O pH é precisamente uma maneira de expressar como ácido ou básico é um líquido levando em consideração a concentração de H3QUALQUER+.
Portanto, substâncias ácidas, como suco de laranja, têm um pH menor que 7 e muitos íons H3QUALQUER+. Enquanto as bases, como Legía, têm um pH maior que 7 e muitos íons OH-.
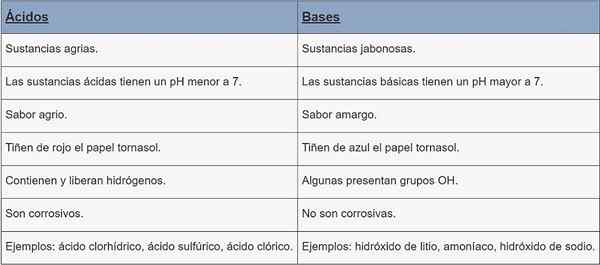
Ácidos | Bases | |
Tipo de substância | Substâncias agrárias. | Jabonesas Substâncias. |
ph | pH menor que 7. | pH maior que 7. |
Sabor | Azedo. | Amargo. |
Coloração | Papel da bacia vermelha. | Cornstasol Paper Tye Blue. |
Caracteristicas | Eles contêm e liberam hidrogênios. | Alguns grupos de OH presentes. |
Corrosão | Eles são corrosivos. | Eles não são corrosivos. |
Exemplos | Ácido clorídrico, ácido sulfúrico, ácido clorico. | Hidróxido de lítio, amônia, hidróxido de sódio. |
Ácidos
 O suco de laranja é um dos representantes ácidos mais conhecidos de nossas vidas diárias
O suco de laranja é um dos representantes ácidos mais conhecidos de nossas vidas diárias Características ácidas
As substâncias ácidas têm certas características:
Sabor azedo
Os ácidos têm um gosto azedo. Rotineiramente, um tipo de sabor é designado com o termo 'ácido'. Assim, diz -se que o suco de limão e o líquido de alguma goma são ácidos, uma vez que seus sabores são azedos e fortes para o palato.
Papel da bacia vermelha
Os ácidos são substâncias capazes de girar a cor do papel de spray azul para vermelho. Shortasol faz parte de um conjunto de substâncias que podem mudar de cor, dependendo do grau de acidez ou basicidade do ambiente em que são encontrados. Essas substâncias são chamadas de indicadores de pH.
Pode atendê -lo: propriedades coligativas de soluçõesEles contêm e liberam hidrogênios
Os ácidos são compostos químicos que possuem o elemento químico de hidrogênio (h), o que lhe confere sua característica de acidez.
Muitas outras substâncias também contêm hidrogênio, mas não podem liberá -lo como acontece com os ácidos. Quando libertador, o hidrogênio está na forma de íons ou cátion+. Estes h+, Ao encontrar as moléculas de água, elas são adicionadas a elas para formar os íons h3QUALQUER+.
Eles transportam corrente elétrica
Devido a átomos H+ que são liberados quando os ácidos na água são dissolvidos, eles são capazes de transportar eletricidade através do uso de baterias ou baterias.
Eles são corrosivos
Existem ácidos fortes que são muito corrosivos. Portanto, o contato com eles deve ser evitado, pois eles podem causar danos físicos graves. Até ácidos fracos, em concentrações muito altas, como acético (o vinagre) podem queimar a pele e a faringe se seus vapores forem respirados.
Forte e fraco
Ácidos fortes produzem uma grande concentração de íons h3QUALQUER+ Quando eles se dissolvem na água. Diz -se que os átomos de hidrogênio dos ácidos fortes são facilmente dissociados. Enquanto isso, os ácidos fracos liberam poucos átomos de hidrogênio e, portanto, produzem uma menor concentração de íons h3QUALQUER+.
Ácidos fortes têm um pH muito baixo, que dependendo da concentração e força do ácido, pode ser 1 ou menos. Em vez disso, os ácidos fracos têm um pH ácido mais alto, que pode ser, por exemplo, 4 ou 5.
Ácidos fortes têm um cheiro que produz uma sensação de queimação. Enquanto isso, os ácidos fracos não apresentam esse tipo de cheiro, mesmo em alguns casos, eles têm odores agradáveis. No entanto, existem muitas exceções, então eles não são recomendados para cheirar até ácidos fracos.
Pode atendê -lo: óxido de ferro (iii): estrutura, nomenclatura, propriedades, usosÁcidos fortes são bons transportadores de eletricidade. Pelo contrário, os ácidos fracos são maus condutores de eletricidade, liberando poucos átomos H+.
Ácidos fortes são capazes de atacar metais, como zinco, formando um grande número de bolhas de hidrogênio. Esta reação não é produzida por ácidos fracos.
Exemplos de ácidos
Ácidos fortes
-HCL: Ácido clorídrico
-H2SW4: ácido sulfúrico
-HBR: ácido bromidrico
-Oi: ácido yodhydric
-Hno3: Ácido nítrico
-HCLO4: ácido perclórico
-HCLO3: Ácido clorico
Ácidos fracos
-CH3COOH: ácido acético
-Hno2: Ácido nitroso
-H2Co3: Ácido carbónico
-H3Po4: ácido fosfórico
-C3H5O (COOH): ácido cítrico
-HF: ácido fluorífrico
-H2SW3: Ácido sulfuroso
Bases
 A amônia é uma substância básica
A amônia é uma substância básica Características básicas
As bases apresentam as seguintes características:
-Eles produzem uma sensação viscosa ou sabão nos dedos, fazendo com que os objetos sejam tomados pelas mãos para ficar escorregadio.
-Eles têm um gosto amargo.
-Eles podem reagir com ácidos, produzindo a formação de compostos chamados sais. Em alguns casos, eles podem precipitar ou afundar na água. Além disso, na reação de uma base com um ácido, a água é formada.
-Eles giram a cor do papel de broto azul, indicando que a solução tem um pH maior que 7 ou alcalino.
-Algumas bases presentes em seus grupos de fórmula química OH, chamados hidroxilli, que são formados por um átomo de hidrogênio e um átomo de oxigênio.
Forte e fraco
Bases fortes são compostos químicos que apresentam um ou mais grupos de OH em sua estrutura química, que quando entram em contato com a água adquirem uma carga negativa, oh-.
Enquanto isso, as bases fracas não se apresentam em seus grupos de hidroxilos de fórmula química. No entanto, bases fracas ao reagir com água também produzem íons ou ânions oh-.
Bases fortes, como o hidróxido de sódio, têm valores de pH muito altos, próximos a 14. Enquanto isso, bases fracas têm pH mais baixo, como a amônia, que tem um pH de 11.
Pode atendê -lo: fervendo: conceito, tipos e exemplosBases fortes são usadas em casas para descobrir os drenos. É o caso do hidróxido de potássio. Enquanto isso, bases fracas são usadas no trabalho de limpeza, como amônia presente em muitos produtos de limpeza.
Exemplos de bases
Bases fortes
-Lioh: hidróxido de lítio
-NaOH: hidróxido de sódio
-KOH: hidróxido de potássio
-RBOH: hidróxido de rubidio
-CSOH: hidróxido de césio
-SR (OH)2: Hidróxido de estrôncio
-Ba (oh)2: hidróxido de bário
Bases fracas
-NH3: amônia
-NHET2: Dietilamina
-NH2CH3: Metilamine
-C5H5N: Piridina
Diferenças entre ácidos e bases
Íons que lançam
Ácidos liberam átomos H+ ou h3QUALQUER+ Quando eles se dissolvem na água. Enquanto isso, as bases liberam ou produzem em contato com íons de água Oh-.
Valores de pH
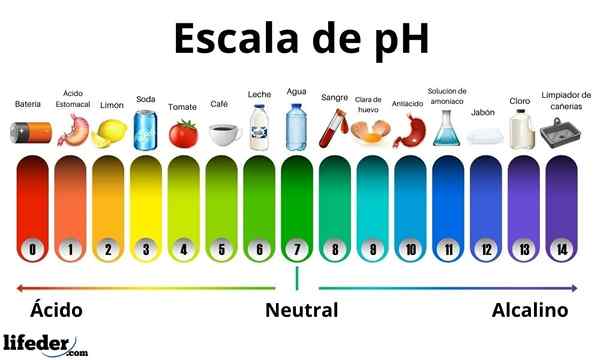
Os ácidos têm um valor de pH entre 0 e 7. Enquanto isso, as bases têm um valor de pH entre 7 e 14. Portanto, os ácidos giram a cor do papel de broto e as bases o transformam em azul.
Reações de treinamento
Os ácidos se originam da reação de óxidos de elementos não metálicos, por exemplo, cloro, enxofre, etc., Com a água, ou eles também são formados quando o hidrogênio é combinado com um elemento não -metálico e, em seguida, o composto formado se dissolve na água (HF, HCl, HBR, etc.).
As bases são produzidas pela reação de óxido de um metal, por exemplo, ferro, cobre, magnésio, etc., Com água. Deve -se lembrar que um óxido é a combinação de átomos de oxigênio com qualquer outro elemento químico.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Helmestine, Anne Marie, Ph.D. (11 de fevereiro de 2020). Definição de ácido e exemplo. Recuperado de: pensamento.com
- Exploradores de ciências. (31 de julho de 2018). Ensinar crianças sobre ácidos e bases. Recuperado de: ScienceExplorers.com
- Excepção de desenho. (2013). Características ácidas. Recuperado de: exemplar.com
- Química do lúmen para não-majors. (s.F.). Propriedades de ácidos e bases. Recuperado de: cursos.Lumenarning.com
- Clark Jim. (2013). Bases fortes e fracas. Recuperado de: Chemguide.co.Reino Unido
- « Flora e fauna da espécie representativa da Serra Equadora
- Estrutura metodológica Como escrevê -lo, estrutura, exemplos »

