Ácido tartárico
- 1426
- 128
- Melvin Mueller
Explicamos o que é o ácido tartárico, suas propriedades físicas e químicas, sua estrutura e suas aplicações
O que é ácido tartárico?
Ele ácido tartárico É um composto orgânico cuja fórmula molecular é COOH (CHOH)2COOH. Possui dois grupos carboxila; Isto é, você pode lançar dois prótons (h+). Em outras palavras, é um ácido dirótico. Também pode ser classificado como um ácido aldárico (açúcar ácido) e um derivado de ácido succínico.
Seu sal é conhecido desde o tempo imemorial e constitui um dos produtos secundários da elaboração do vinho. É cristalizado como um sedimento branco batizado como "diamantes de vinho", que se acumulam na cortiça ou no fundo dos barris e garrafas. Este sal é biitartrado de potássio (ou ácido potássio Tartrato).
Os sais de ácido tartárico têm em comum a presença de um ou dois cátions (Na+, K+. NH4+, AC2+, etc.) porque, ao liberar seus dois prótons, ele permanece negativamente carregado com uma carga de -1 (como nos sais Biterrato) ou -2.
Por sua vez, este composto tem sido objeto de estudo e ensino de teorias orgânicas relacionadas à atividade óptica, mais precisamente com a estereoquímica.
Onde está o ácido tartárico?
O ácido tartárico é um componente de muitas plantas e alimentos, como damasco, abacates, maçãs, tamarindos, sementes de girassol e uvas.
No processo de envelhecimento dos vinhos, esse ácido - a temperaturas frias - é combinado com potássio para cristalizar como Tartrato. Nos vinhos vermelhos, a concentração desses tartrats é menor, enquanto em vinhos brancos eles são mais abundantes.
Tartratos são sais de cristais brancos, mas quando ocluem impurezas do ambiente alcoólico, adquirem tons avermelhados ou roxos.
Pode atendê -lo: reação de deslocamentoEstrutura do ácido tartárico
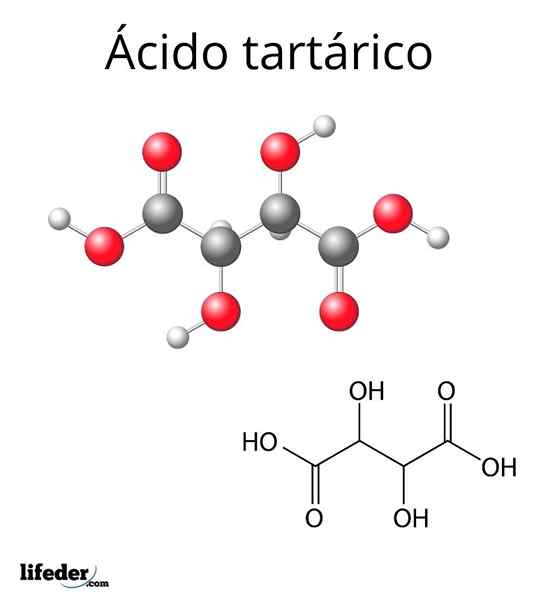
 Estrutura molecular do ácido tartárico
Estrutura molecular do ácido tartárico A estrutura molecular do ácido tartárico é representada na imagem superior. Os grupos carboxil (-COOH) estão localizados nas extremidades laterais e são separados por uma cadeia curta de dois carbono (C2 e C3).
Por sua vez, cada um desses carbonos está ligado a uma H (esfera branca) e um grupo OH. Esta estrutura pode girar o link C2-C3, gerando assim várias conformações que estabilizam a molécula.
Isto é, a ligação central da molécula quebrada como um cilindro rotativo, alternando consecutivamente a disposição espacial dos grupos -cooh, H e OH (projeções de Newman).
Por exemplo, na imagem, os dois grupos de OH apontam em direções opostas, o que significa que eles estão em anti -posições entre si. O mesmo vale para grupos -cooh.
Outra conformação possível é a de alguns grupos eclipsados, nos quais ambos os grupos são orientados na mesma direção. Essas conformações não desempenhariam um papel importante na estrutura do composto se todos os grupos de carbonos C2 e C3 Eles eram iguais.
Como neste composto, os quatro grupos são diferentes (-cooh, oh, h e o outro lado da molécula), os carbonos são assimétricos (ou quirais) e exibem a famosa atividade óptica.
A maneira como os grupos são organizados em carbonos2 e C3 do ácido tartárico determina algumas estruturas e propriedades diferentes para o mesmo composto; isto é, permite a existência de estereoisômeros.
Aplicações de ácido tartárico
Na indústria de alimentos
É usado como um estabilizador de elogios em padarias. Também é usado como ingrediente para fermento, geléia, gelatina e refrigerantes. Ele também cumpre as funções como uma acidificação, biblioteca e licitante de íons.
Pode atendê -lo: brometo de sódio (NABR)O ácido tartárico é encontrado nesses alimentos: biscoitos doces, doces, chocolates, fluidos gasosos, produtos de padaria e vinhos.
Na elaboração dos vinhos, ele é usado para torná -los mais equilibrados, do ponto de vista gustatório, diminuindo o pH destes.
Na indústria farmacêutica
É usado na criação de pílulas, antibióticos e pílulas efervescentes, bem como nos medicamentos usados no tratamento de doenças cardíacas.
Na indústria química
É usado na fotografia, bem como na galvanotecnia e é um antioxidante ideal para gorduras industriais.
Também é usado como um seqüestrador de íons de metal. Como? Girando seus elos de forma que você possa localizar os átomos de oxigênio do grupo carbonil, rico em elétrons, ao redor dessas espécies carregadas positivamente.
Na indústria da construção
Atrasar o processo de endurecer o gesso, cimento e gesso, tornando a manipulação desses materiais mais eficiente.
Propriedades do ácido tartárico

As aplicações de ácido tartárico mais comuns são:
- O ácido tartárico é comercializado na forma de pó cristalino ou cristais brancos ligeiramente opacos. Tem um sabor agradável, e essa propriedade é indicativa de um vinho de boa qualidade.
- Derrete a 206 ºC e queima a 210 ºC. É muito solúvel em água, álcoois, soluções básicas e bórax.
- Sua densidade é de 1,79 g/ml a 18 ºC e apresenta duas constantes de acidez: PKA1 e pka2. Ou seja, cada um dos dois prótons ácidos tem sua própria tendência de se libertar no ambiente aquoso.
- Como os grupos -coh e OH, ele pode ser analisado por espectroscopia infravermelha (IR) por suas determinações qualitativas e quantitativas.
- Outras técnicas, como espectroscopia de massa e ressonância magnética nuclear, permitem a análise anterior deste composto.
Estereoquímica

O ácido tartárico foi o primeiro composto orgânico ao qual uma resolução enantiomérica foi desenvolvida. O que isto significa? Isso significa que seus estereoisômeros podem ser separados manualmente graças ao trabalho de pesquisa do bioquímico Louis Pasteur, em 1848.
E quais são os estereoisômeros do ácido tartárico? Estes são: (r, r), (s, s) e (r, s). R e S são as configurações espaciais de carbonos C2 e C3.
O ácido tartárico (r, r), o mais "natural", gira a luz polarizada para a direita; O ácido tartárico (s, s) é quebrado à esquerda, ao contrário das agulhas do relógio. E, finalmente, o ácido tartárico (r, s) não quebra a luz polarizada, sendo opticamente inativa.
Louis Pasteur, com a ajuda de um microscópio e uma pinça, encontrou e separados cristais de ácido tartárico que mostraram padrões "direito direito" e "esquerdo", como na imagem superior.
Dessa maneira, os cristais "com a direita" são aqueles formados pelo enantiômero (r, r), enquanto os cristais "à esquerda" são os do enantiômero (s, s).
No entanto, os cristais do ácido tartárico (r, s) não diferem dos outros, pois exibem características qualificadas e esquerdas ao mesmo tempo; Portanto, eles não poderiam ser "resolvidos".
Referências
- Wikipedia. (2018). Ácido tartárico. Recuperado de.Wikipedia.org
- PubChem. (2018). Ácido tartárico. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Entendendo os tortações de vinho. Recuperado de Jordanwinery.com
- Ativo. Ácido tartárico. Recuperado da Actipedia.org
- Pochteca. Ácido tartárico. Pochteca se recuperou.com.mx
- Dhanesshwar Singh et al. (2012). Sobre a origem da inatividade óptica do ácido meso-tartarico. Departamento de Química, Universidade de Manipur, Canchipur, Imphal, Índia. J. Chem. Farm. Carne bovina., 4 (2): 1123-1129.

