Estrutura do ácido sulfámico, propriedades, síntese, usa
- 4194
- 1176
- Conrad Schmidt
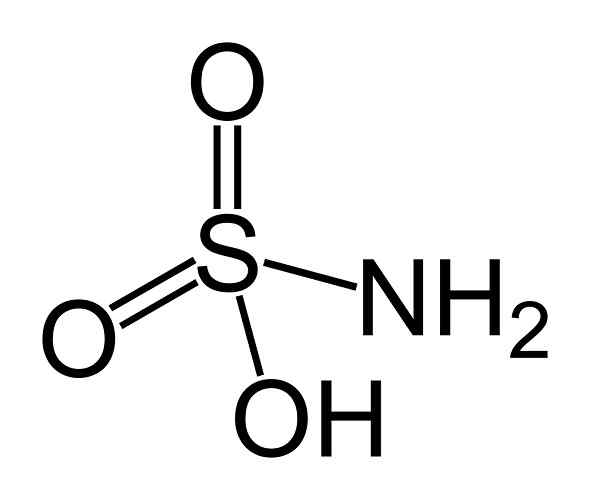
Ele ácido sulfâmico É um composto inorgânico formado por um átomo de enxofre (s) ligado em uma forma covalente e por um link simples para um grupo hidroxila (-OH) e um grupo amino (-nhh2) e por ligação dupla para dois átomos de oxigênio (O). É um sólido cristalino branco. Sua fórmula química é NH2SW3H. Também é conhecido como ácido aminossulfônico, ácido amidosulfônico, ácido amidosulfúrico e ácido sulfamídico.
O ácido sulfámico é um ácido forte. Você pode reagir com metais, metal e óxidos de carbonato. Seus sais geralmente são solúveis em água, por isso é um bom removedor de incrustações em equipamentos de processo. É freqüentemente usado em fábricas de açúcar para limpar incrustações de carbonato em evaporadores.
 Estrutura do ácido sulfámico. Benjah-BMM27 [domínio público]. Fonte: Wikipedia Commons.
Estrutura do ácido sulfámico. Benjah-BMM27 [domínio público]. Fonte: Wikipedia Commons. O ácido sulfámico é um redutor de nitritos (não2-) e esta propriedade química é usada em várias aplicações, como na indústria de corantes e análise de nitritos.
Utiliza -se no bronzeamento de couro e no branqueamento da polpa para fabricação de papel. De fato, é um contaminante de comida, pois é frequentemente encontrado nos papéis e cartões que são usados para embalar os supermercados.
Também é usado no eletrodo de metal, como padrão de laboratório e um de seus derivados é um herbicida muito eficaz.
[TOC]
Estrutura
O ácido sulfâmico cristaliza na forma de cristais de ortorrombus bipiramidal. Formam prismas e folhas compactos quando cristalizam a partir de solução fria, bem como folhas de rombus quando a torna uma solução aquosa quente.
Nomenclatura
- Ácido sulfâmico
- Ácido aminossulfônico
- Ácido amidossulfônico
- Ácido amidossulfúrico
- Sulfami -idid
Propriedades
Estado físico
Sólido cristalino branco.
Peso molecular
97,1 g/mol.
Ponto de fusão
205 ºC, decompõe -se em 209 ºC.
Densidade
2,15 g/cm3
Solubilidade
Solúvel em água:
- 12,8% a 0 ºC
- 17,57% a 20 ºC
- 22,77% a 40 ° C
Dificilmente solúvel em metanol, ligeiramente solúvel em acetona, insolúvel em éter.
Livremente solúvel em bases de nitrogênio e solventes orgânicos contendo nitrogênio.
Insolúvel em dissulfeto de carbono (CS2) e tetracloreto de carbono (CCL4).
ph
0,41 (na solução 1 n, ou seja, 1 equivalente/l).
Constante de dissociação
0,101 a 25 ºC.
Propriedades quimicas
É um ácido forte. Quase tanto quanto os ácidos clorídrico (HCl), nítrico3) e sulfúrico (H2SW4).
Pode atendê -lo: compostos oxigenados: propriedades, reações, usosAs soluções aquosas de ácido sulfâmico são altamente ionizadas. Seu pH é menor que as soluções de ácidos fosfóricos e oxálicos.
Na água, o ácido sulfâmico perde apenas o próton que está ligado ao oxigênio. Os hidrogênios jovens de nitrogênio permanecem firmemente unidos.
Em solução aquosa, é lentamente hidrolisado para dar sulfato de ácido de amônio (NH4HSO4). É estável em condições secas.
O ácido sulfámico ataca metais, óxidos de metal e carbonatos para gerar sulfamatos. Por exemplo, com metal de potássio (k) sulfamato de potássio (koso2NH2) e hidrogênio (H2).
Todos os sais de ácido sulfâmico são solúveis em água. Os sais de cálcio, chumbo e bário são muito solúveis em água, ao contrário do ácido sulfúrico correspondente.
Ácido nitroso (hno2) reagir quantitativamente com o grupo amino de ácido sulfâmico, liberando nitrogênio (n2). Estima -se que o íon sulfamato funcione nesta reação como um amida, não como uma amina.
O ácido sulfámico é oxidado por cloro, bromo ou clorato de potássio para convertê -lo em ácido sulfúrico. Esta reação não ocorre com outros oxidantes, como ácido crômico ou permanganato de potássio.
Não é compatível (reage) com alcales fortes, cloro, ácido hipocloroso, hipocloritos, cianetos e sulfetos.
Outras propriedades
Não é higroscópico (isso significa que não absorve a umidade do ar).
Quando aquecido até que a decomposição emite vapores altamente tóxicos de óxidos de enxofre e cloreto de hidrogênio (HCl).
Um de seus derivados, o sulfamato de amônio, é um retardador de incêndio.
É moderadamente tóxico.
Síntese
O ácido sulfámico é obtido pela reação da uréia (NH2)2 Com o ácido sulfúrico, ou seja, ácido sulfúrico (H2SW4) concentrado contendo trióxido de enxofre (então3).
Também pode ser sintetizado reagindo ácido clorossulfônico (HCLO3Cl) e amônia (NH3).
Formulários
Na indústria para colorir
O ácido sulfámico é usado para remover o excesso de nitritos de maneira rápida e eficaz nas reações de diazotização na síntese de coloração. É muito mais prático que a uréia para esse fim.
No processamento de couro
Durante o bronzeamento de couro, o uso de ácido sulfâmico em vez de ácido sulfúrico fornece uma textura mais fina e sedosa.
Pode atendê -lo: minerais de metalAlém disso, como o sulfamato de cálcio é solúvel em água, diferentemente do sulfato de cálcio, o ácido sulfámico pode ser usado no processo desencantado sem deixar pontos que às vezes ocorrem em couro quando usado ácido sulfúrico.
 Calçados de couro. Fonte: Pixabay.
Calçados de couro. Fonte: Pixabay. No equipamento de processo de limpeza
O ácido sulfámico é usado como um limpador de descalcificador em furúnculos, reatores, tubos, sistemas de refrigeração e trocadores de calor.
Nesses equipamentos, incrustam para a circulação de água ou compostos do processo em usinas de energia, plantas químicas, abordagens, fábricas de papel, estações de compressão e outras indústrias são formadas.
As incrustações ou depósitos sólidos podem ser orgânicos (algas, lodo, fungos) ou inorgânicos (óxidos de ferro, sulfetos de ferro, carbonatos de cálcio ou magnésio, sulfatos, fosfatos ou silicatos).
O ácido sulfámico é muito eficaz quando usado para eliminar incrustações de carbonato de cálcio. Pode ser usado em equipamentos de cobre, latão, aço inoxidável, ferro fundido e aço galvanizado.
É usado em solução de 5 a 10% em peso. É usado especialmente em fábricas de açúcar para limpar evaporadores feitos de ferro fundido com trocadores de calor de cobre.
 Equipe de evaporador em um moinho de açúcar. Autor: Antiksh Kumar. Fonte: Pixabay
Equipe de evaporador em um moinho de açúcar. Autor: Antiksh Kumar. Fonte: Pixabay Deve ser usado em temperaturas não maiores que 50-60 ºC. As temperaturas de 70 ºC levam à formação de sulfatos insolúveis, como o caso4.
Quando usado combinado com cloreto de sódio, ocorre um efeito de sinergia e a solução permite que o óxido férrico se dissolva lentamente. Nesse caso, não deve ser usado com aço inoxidável porque o ácido clorídrico é liberado, o que pode causar corrosão nesse material.
Em refino de metal
Eletrodeposição de metal, como cobre, prata, cobalto, níquel, zinco, cádmio, ferro e chumbo, pode ser realizada com sucesso em soluções de ácido sulfâmico. Isso pode ser tratado muito mais fácil do que o ácido ácido hidrófico (h2Sif6).
Como um reagente de padrão em laboratório
Dadas certas características do ácido sulfâmico, como: sua força como ácido, sua facilidade a ser purificada pela recristalização na água, sua estabilidade e sua não-hidroscopicidade, ele tem sido usado como padrão primário no nível do laboratório. Isso significa que é usado para determinações quantitativas de alcalina.
 Laboratório. PublicDomaiaipictures. Fonte: Pixabay
Laboratório. PublicDomaiaipictures. Fonte: Pixabay Em análise de nitritos
Devido à sua reação fácil com nitritos, o ácido sulfámico é usado para determinar destes em solução.
Pode servir a você: ácido tricloroacético: estrutura, propriedades, síntese, usos, efeitosNa análise da água dissolvida na água
Como o ácido sulfâmico reagindo com nitritos de água é liberado nitrogênio, é possível determinar o oxigênio dissolvido na água, pois a interferência causada por nitritos é eliminada.
Na preparação de óxido nitroso
O ácido sulfámico reage com o ácido nítrico que gera óxido nitroso (n2QUALQUER). Esta reação é mais segura que o nitrato de amônio para obter o referido gás.
Na agricultura
Um derivado de ácido sulfámico, sulfamato de amônio, é um herbicida não -tóxico para animais.
É aplicado pelo orvalho nas folhas da espécie a ser eliminado no final do verão ou no início do outono, de preferência em clima úmido. Ao mover o composto das folhas para as raízes, a planta morre.
 Aplicação de herbicida Rocío. Autor: Zefe Wu. Fonte: Pixabay
Aplicação de herbicida Rocío. Autor: Zefe Wu. Fonte: Pixabay Outra vantagem desse complexo é que o solo não esteriliza permanentemente. De fato, algum nitrogênio de sulfamato de amônio estará disponível no chão para o crescimento das plantas na próxima temporada.
Em tecidos à prova de fogo
Sua compatibilidade com celulose e seu retardador de incêndio converteram sulfamato de amônio em um agente para obter tecidos e papel resistentes ao fogo.
10% do peso do tecido é usado, cuja aparência e sensação de toque permanecem inalterados. O tecido quando está em uso deve ser lavado seco, nunca lavado com água para não se dissolver no sulfamato.
É útil especialmente em teatros ou lugares semelhantes.
 Teatro. Autor: Mustangjoe Fonte: Pixabay
Teatro. Autor: Mustangjoe Fonte: Pixabay Em várias aplicações
É usado como catalisador em algumas reações químicas, como na preparação de resinas de uréia-formalde. Também é útil como bactericida e estabilizador de cloro em piscinas e como uma alvejante de polpa de madeira em fábricas de polpa e papel.
Referências
- OU.S. Biblioteca Nacional de Medicina. (2019). Ácido sulfâmico. Recuperado de PubChem.NCBI.Nlm.NIH.Gov
- Williams, d.eu.H. (2004) Nitrosação em centros de nitrogênio. Em reações de nitrosação e química do óxido nítrico. Capítulo 2. Recuperado de cientedirect.com
- Clapp, Leallyn B. (1943). Ácido sulfâmico e seus usos. Chem. Educ. 1943, 20, 4, 189. Recuperado de bares.ACS.org
- McDonald, James. (2003). Ácido sulfâmico. Recuperado da Veoliawatertech.com
- Sastri, v.S. (2010). Gestão e controle da corrosão. Na corrosão de Shreir. Recuperado de cientedirect.com
- Bajpai Pratima. (2018). Tópicos diversos. No manual de polpa e papel de Biermann. Terceira edição. Recuperado de cientedirect.com
- « Sons agudos características e exemplos
- Estrutura do vírus monocatenário, replicação, importância »

