Estrutura de ácido nitroso (HNO2), propriedades, síntese

- 2511
- 34
- Tim Mann
Ele ácido nitroso É um ácido fraco e inorgânico, cuja fórmula química é hno2. Está fundamentalmente em solução aquosa com uma coloração azul pálida. É muito instável e é rapidamente quebrado em óxido nítrico, não, e em ácido nítrico, Ino3.
Geralmente está em solução aquosa na forma de nitritos. Também é naturalmente da atmosfera como resultado da reação do óxido nítrico com água. Lá, especificamente na troposfera, o ácido nitroso intervém na regulação da concentração de ozônio.
 Solução de ácido nitroso em um copo. Fonte: nenhum autor legível por máquina fornecido. O cientista louco ~ Commonswiki assumiu (com base em reivindicações de direitos autorais). [Domínio público]
Solução de ácido nitroso em um copo. Fonte: nenhum autor legível por máquina fornecido. O cientista louco ~ Commonswiki assumiu (com base em reivindicações de direitos autorais). [Domínio público] Na imagem superior, uma solução HNO é mostrada2 onde a característica cor azul pálida desse ácido pode ser visto. É sintetizado pela dissolução do trióxido de nitrogênio, n2QUALQUER3, Na água. Da mesma forma, é o produto da acidificação de soluções de nitrito de sódio a baixas temperaturas.
O hno2 Tem pouco uso comercial, usando na forma de nitrito na conservação da carne. Por outro lado, é usado na elaboração de corantes azóicos.
É usado, juntamente com o tiossulfato de sódio, no tratamento de pacientes com envenenamento por cianeto de sódio. Mas, é um agente mutagênico e pensa -se que pode causar substituições nas bases das cadeias de DNA, através de uma desaminação oxidativa da citosina e adenina.
O ácido nitroso tem um comportamento duplo, pois pode se comportar como um agente oxidativo ou como um agente redutor; isto é, pode ser reduzido a não ou n2, oxidar3.
[TOC]
Estrutura do ácido nitroso
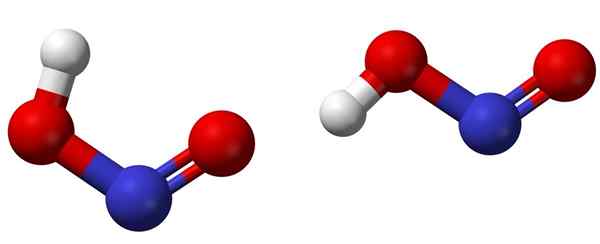 Isômeros cis (esquerda) e trans (direita) com as respectivas estruturas moleculares de HNO2. Fonte: Ben Mills [domínio público].
Isômeros cis (esquerda) e trans (direita) com as respectivas estruturas moleculares de HNO2. Fonte: Ben Mills [domínio público]. A imagem superior mostra a estrutura molecular do ácido nitroso por meio de um modelo de esferas e barras. O átomo de nitrogênio (esfera azul) está localizado no centro da estrutura, formando uma ligação dupla (n = o) e um simples (n-o) com átomos de oxigênio (esferas vermelhas).
Observe que o átomo de hidrogênio (esfera branca) está ligada a um dos oxigênio e não diretamente ao nitrogênio. Então, sabendo disso, a fórmula estrutural do HNO2 É [ho-n = o] ou [não (oh)], e não existe um link H-N (como a fórmula química pode pensar).
As moléculas de imagem correspondem às de uma fase gasosa; Na água, eles estão cercados por moléculas de água, que podem aceitar o íon hidrogênio (fracamente) para formar os íons não2- e h3QUALQUER+.
Pode atendê -lo: BeakerSuas estruturas podem adotar duas formas: cis ou trans, chamadas isômeros geométricos. No isômero cis, o átomo H é eclipsado com o átomo de oxigênio vizinho; Enquanto estiver no isômer trans, ambos são encontrados em posições anti -opo.
No isômero cis, é provável a formação de um hidrogênio intramolecular (OH-NO), o que pode importar intermolecular (Onoh-ooh).
Propriedades
Nomes químicos
-Ácido nitroso
-Ácido dioxonítico (iii)
-Hidróxido de nitrosile
-Hidroxideoxidonitrogênio (nome sistemático da IUPAC)
Descrição física
Líquido azul pálido, correspondente à solução de nitrito.
Peso molecular
47.013 g/mol.
Constante de dissociação
É um ácido fraco. Seu PKA é de 3,35 a 25 ºC.
Ponto de fusão
Só é conhecido em solução. Portanto, seu ponto de fusão não pode ser calculado, nem seus cristais podem ser isolados.
Ponto de ebulição
Por não existentes, mas na água, as medições desta propriedade não são precisas. Por um lado, depende da concentração do HNO2, E por outro, seu aquecimento produz sua decomposição. É por isso que um ponto de ebulição exato não é relatado.
Formação de vendas
Nitritos solúveis em água solúvel com li+, N / D+, K+, AC2+, Senhor2+, BA2+. Mas, não forme sais com cátions versáteis, como: para o3+ e/ou ser2+ (devido à sua alta densidade de carga). É capaz de formar ésteres estáveis com álcoois.
Potencial de incêndio
É inflamável para reações químicas. Pode explodir por contato com o tricloreto de fósforo.
Decomposição
É um composto muito instável e, em solução aquosa, se decompõe em óxido nítrico e ácido nítrico:
2 hno2 => Não2 + Não +h2QUALQUER
4 hno2 => 2 hno3 + N2Ou +h2QUALQUER
Agente redutor
O ácido nitroso em solução aquoso é apresentado na forma de íons nitritos, não2-, que experimentam várias reações de redução.
Reage com íons i- e fé2+, Na forma de nitrito de potássio, para formar óxido nítrico:
2 KNO2 + Ki +h2SW4 => I2 + 2 não +2 h2Ou +k2SW2
O nitrito de potássio na presença de íons de lata é reduzido para formar óxido nitroso:
Kno2 + 6 HCl +2 SNCl2 => 2 SNCl4 + N2O +3 h2O +2 kcl
Pode servir você: hidróxido de beryl (be (oh) 2)O nitrito de potássio é reduzido por Zn em um ambiente alcalino, formando amônia:
5 h2O +Kno2 + 3 Zn => NH3 + KOH +3 Zn (OH)2
Agente oxidante
Além de ser um agente redutor, o ácido nitroso pode intervir nos processos de oxidação. Por exemplo: oxidam o sulfeto de hidrogênio, tornando -se óxido nítrico ou de amônia, dependendo da acidez do meio em que a reação ocorre.
2 hno2 + H2S => s +2 não +2 h2QUALQUER
Hno2 + 3 h2S => s +NH3 + 2 h2QUALQUER
Ácido nitroso, em um meio de pH ácido, pode oxidar o íons de iodeto em iodo.
Hno2 + Yo- + 6 h+ => 3 i2 + NH3 + 2 h2QUALQUER
Você também pode atuar como um agente redutor atuando no CU2+, causando ácido nítrico.
Nomenclatura
Para o hno2 Você pode dar outros nomes, que dependem do tipo de nomenclatura. O ácido nitroso corresponde à nomenclatura tradicional; ácido dioxonítrico (iii), para a nomenclatura de ações; e Dioxonitrato (III) de hidrogênio, para o sistema sistemático.
Síntese
O ácido nitroso pode ser sintetizado dissolvendo o trióxido de nitrogênio na água:
N2QUALQUER3 + H2O => 2 hno2
Outro método de preparação é a reação do nitrito de sódio, nano3, com ácidos minerais; como ácido clorídrico e ácido bromidérico. A reação é feita em baixa temperatura e o ácido nitroso é consumido in situ.
Irmão mais velho3 + H+ => Hno2 + N / D+
O h+ Vem de HCl ou HBr.
Riscos
Dadas suas propriedades e características químicas, há pouca informação sobre os efeitos tóxicos diretos do HNO2. Talvez alguns efeitos prejudiciais que se acredita sejam produzidos por este composto, são realmente causados por ácido nítrico, o que pode ocorrer decompondo ácido nitroso com ácido nitroso.
É apontado que o hno2 Pode ter efeitos nocivos nas vias aéreas e ser capaz de produzir sintomas de irritação em pacientes asmáticos.
Na forma de nitrito de sódio, é reduzido pela desoxihemoglobina, produzindo óxido nítrico. Este é um vasodilatador poderoso que produz relaxamento dos músculos lisos vasculares, estimando em humanos uma dose LD50 de 35 mg/kg para consumo oral.
A toxicidade do nitrito de sódio se manifesta com um colapso cardiovascular, seguido de hipotensão grave, devido à ação vasodilatadora do óxido nítrico, produzido a partir de nitrito.
Dióxido de nitrogênio, não2, Presente no ar contaminado (poluição), sob certas condições, pode causar ácido nitroso; que por sua vez podem reagir com aminas para formar nitrosamina, uma gama de compostos carcinogênicos.
Pode servir você: óxido de prata (AG2O)Uma reação semelhante ocorre com a fumaça dos cigarros. Resíduos de nitrosamina aderiram ao revestimento interno de veículos fumantes foram encontrados.
Formulários
Produção de vendas de diazônio
O ácido nitroso é usado na indústria na produção de sais de diazônio, através de sua reação com aminas e fenóis aromáticos.
Hno2 + Rnah2 + H+ => RNA = NAR +H2QUALQUER
Os sais de diazônio são usados em reações de síntese orgânica; Por exemplo, na reação de Sandmeyer. Nesta reação, ocorre a substituição de um grupo amino (H2N-), em uma amina aromática primária, pelos grupos CL-, Br- e cn-. Para obter esses produtos aromáticos, são necessários sais de coupro.
Os sais de diazônio podem formar compostos brilhantes de telhado que são usados como corantes e também servem como um teste qualitativo para detectar a presença de aminas aromáticas.
Eliminação de sódio azida
O ácido nitroso é usado para eliminar a azid de sódio3), o que é potencialmente perigoso para sua tendência de explorar.
2 nan3 + 2 hno2 => 3 n2 + 2 NO +2 Naoh
Síntese de Oxelos
O ácido nitroso pode reagir com grupos de cetona para formar oxelos. Estes podem ser oxidados para formar carboxilas ou ácido reduzido para causar amina.
Este processo é usado na preparação comercial de ácido adipico, um monômero usado na produção de nylon. Ele também intervém na produção de poliuretano e seus ésteres são plastificantes, principalmente no PVC.
Sob sua forma salina
O ácido nitroso, na forma de nitrito de sódio, é usado no tratamento e conservação da carne; Desde então, evita o crescimento bacteriano e é capaz de reagir com a mioglobina, produzindo uma cor vermelha escura que torna a carne mais atraente para o consumo.
Esse mesmo sal é usado, juntamente com o tiossulfato de sódio, no tratamento intravenoso de envenenamento por cianeto de sódio.
Referências
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. Aminas. (10º Edição.). Wiley Plus.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- PubChem. (2019). Ácido nitroso. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Softschools. (2019). Ácido nitroso. Recuperado de: Softschools.com
- Wikipedia. (2019). Ácido nitroso. Recuperado de: em.Wikipedia.org
- Sociedade Real de Química. (2015). Ácido nitroso. Recuperado de: chemspider.com
- Enciclopédia do Novo Mundo. (2015). Ácido nitroso. Recuperado de: newworldyclopedia.org
- DrugBank. (2019). Ácido nitroso. Recuperado de: Drugbank.AC
- Formulação química. (2018). Hno2. Recuperado de: formulação Quimica.com
- « Números ou indicadores que falam sobre avanços educacionais em um país
- Propriedades de alquil halogenuros, obtenção, exemplos »

