Ácido hipossulfuroso
- 2123
- 292
- Dennis Heidenreich
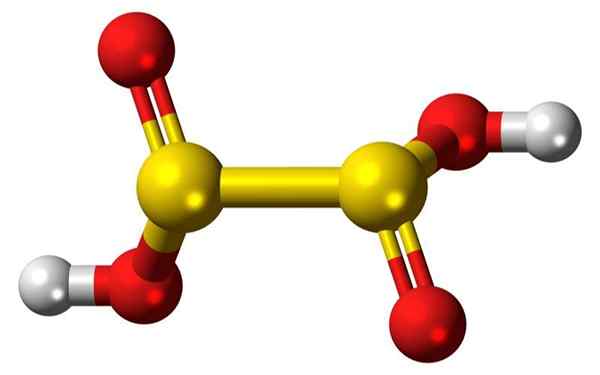
 Bar 3d de barras e balões de uma molécula de ácido hipossulfuroso. Fonte: Jynto
Bar 3d de barras e balões de uma molécula de ácido hipossulfuroso. Fonte: Jynto O que é ácido hipossulfuroso?
Ele Ácido hipossulfuroso, Ó ácido dônico, é desconhecido, instável puramente, não tem existência independente e não foi detectado em solução aquosa.
Teoricamente, seria um ácido relativamente fraco, comparável ao ácido de enxofre, H2SO3. Somente seus sais são conhecidos, os Dionitos, que são estáveis e são poderosos agentes redutores. O sal de ácido dônico de sódio é dionito de sódio.
Fórmulas
As fórmulas de ácido hipossulfuroso são as seguintes:
Ácido dônico: h2S2QUALQUER4
Ânion dionito: S2O42−
Dionito de sódio: na2S2QUALQUER4
Número CAS: 20196-46-7 ácido hiposulfuroso (ou dital)
Número CAS: 14844-07-6 ácido hiposulfuroso (ou dição, íon)
Número CAS: 7775-14-6 Dionito de sódio (sódio de sódio de ditoring ácido)
Propriedades físicas e químicas
- No sal dionito de sódio, sua aparência é uma poeira cristalina, branca a acinzentada, com flocos de um verde de limão leve e fraco de enxofre.
- O peso molecular do ácido de Ditação é 130.132 g/mol. O ânion dionito, 128.116 g/mol, e o sódio dionito, 174.096 g/mol.
- No ponto de ebulição do dionito de sódio, ele se decompõe e seu ponto de fusão é 52 ° C.
- A densidade do dionito de sódio é 2.38 g/cm³ (anidro), e sua solubilidade na água é 18.2 g/100 ml (anidro, 20 ° C).
- O ácido hipossulfuroso é um oxoácido de enxofre com a fórmula química H2S2QUALQUER4.
- Oxoácidos de enxofre são compostos químicos que contêm enxofre, oxigênio e hidrogênio. No entanto, alguns deles são conhecidos apenas por seus sais (como ácido hipossulfuroso, ácido dicional, ácido dissulfeto e ácido de enxofre).
Pode servir a você: piridina: estrutura, propriedades, usos, toxicidade, sínteseEntre as características estruturais dos oxoácidos que temos:
- Enxofre tetraédrico quando coordenado com oxigênio.
- Átomos de oxigênio na ponte e terminal.
- Grupos periódicos.
- S = s terminais.
- Correntes de (-s-) n
O ácido sulfúrico é o oxoácido de enxofre mais conhecido.
- O ânion dionito ([s2QUALQUER4] 2-) é um oxoanion (um íon com a fórmula genérica axoy z-) de enxofre formalmente derivado do ácido dicional.
- Os dionitos experimentam hidrólise ácida e alcalina em tiossulfato e bissulfito, e sulfito e sulfeto.
- O sal de ácido dônico de sódio é dionita de sódio (também conhecida como hidrossulfito de sódio).
- Pode ser obtido do bissulfito de sódio através da seguinte reação:
2 Nahso3 + Zn → Na2SW4 + Zn (OH) ²
Formulários
O íon dionita é frequentemente usado em conjunto com um agente complexo (por exemplo, ácido cítrico), para reduzir o oxi-hidroxido de ferro (III) em compostos solúveis de ferro (ii) e eliminar as fases minerais amorfas que contêm ferro (III) no solo Análise (extração seletiva).
Dionito permite aumentar a solubilidade do ferro. Graças à forte afinidade do Ion Dionito por cátions metálicos bivalentes e trivalentes, é usado como agente quelante.
A decomposição de Dionito produz espécies de enxofre reduzidas que podem ser muito agressivas para a corrosão de aço e aço inoxidável.
Entre as aplicações do sódio Dionito, temos:
Na indústria
- Este composto é um sal solúvel em água e pode ser usado como um agente redutor em soluções aquosas.
- É usado como tal em alguns processos de corante industrial, principalmente aqueles que envolvem corantes de enxofre e corantes da banheira, nos quais um corante insolúvel em água pode ser reduzido a um sal de metal alcalino solúvel em água (por exemplo, o corante índigo).
Pode atendê -lo: ácidos: características e exemplos- As propriedades de redução de dionito de sódio também eliminam o excesso de corante, óxido residual e pigmentos indesejados, melhorando assim a qualidade global da cor.
- Dionito de sódio também pode ser usado para tratamento de água, purificação de gás, limpeza e extração. Também pode ser usado em processos industriais, como um agente sulfonante ou uma fonte de sódio.
- Além da indústria têxtil, este composto é usado em indústrias, alimentos, polímeros, fotografia e muitos outros relacionados a couro e muitos outros. Também é usado como um agente descolorante em reações orgânicas.
Em ciências biológicas
- O dionito de sódio é frequentemente usado em experimentos de fisiologia como um meio de reduzir o potencial redox das soluções.
Em ciências geológicas
- O dionito de sódio é frequentemente usado em experimentos de química do solo para determinar a quantidade de ferro que não é incorporada em minerais primários de silicato.
Segurança e riscos
A manipulação desse elemento deve ser feita em condições de atendimento extremas. É extremamente tóxico e pode reagir perigosamente em conjunto com água e ar.
Em seguida, destacamos alguns aspectos.
Reações de ar e água
- O dionito de sódio é um combustível sólido que se decompõe lentamente quando está em contato com água ou vapor de água, formando tiossulfatos e bissulfitos.
- Essa reação produz calor, que pode acelerar ainda mais a reação ou fazer com que os materiais circundantes queimem. Se a mistura estiver confinada, a reação de decomposição pode resultar na pressurização do contêiner, que pode ser quebrado fortemente. Ao permanecer no ar, ele oxida lentamente, gerando gases tóxicos de dióxido de enxofre.
Pode atendê -lo: nitrofuranos: características, mecanismo de ação e classificaçãoPerigo de incêndio
- O dionito de sódio é um material inflamável e combustível. Pode ser inflamado em contato com ar molhado ou umidade. Você pode queimar rapidamente com efeito de flare. Pode reagir vigorosamente ou explosivamente em contato com a água.
- Pode ser quebrado explosivamente quando aquecido ou está envolvido em um incêndio. Pode ligar novamente depois que o incêndio for extinto. O escoamento pode criar perigo de incêndio ou explosão. Os recipientes podem explodir quando aquecido.
Perigo de saúde
- Ao entrar em contato com o fogo, o dionito de sódio produzirá gases irritantes, corrosivos e/ou tóxicos. A inalação de produtos de decomposição pode causar ferimentos graves ou morte. O contato com a substância pode causar queimaduras graves na pele e nos olhos. O escoamento de controle de incêndio pode causar contaminação.
Referências
- Benjah-BMM27 (2006). Um modelo de bola e bastão do íon ditionita [imagem] recuperado de.Wikipedia.org.
- Mills, b. (2009). Bolls de sódio-ditionita -xtal-1992-3d [imagem] recuperados de: em.Wikipedia.org.

