Síntese, procedimento, uso, riscos, riscos do ácido fenoxiacético
- 3150
- 600
- Orlando MacGyver
Ele Ácido fenoxiacético É uma substância orgânica, formada pela reação entre fenol e ácido monocloroacético na presença de uma solução de hidróxido de sódio. O procedimento usado para obter este produto é chamado de síntese dos éteres de Williamson.
O ácido fenoxiacético sintetizado é um precipitado branco ou incolor, formado por cristais em forma de agulha, praticamente insolúveis em água (solubilidade em água 12 g/l l l l-1), Mas solúvel em ácido acético, fenol e éter.
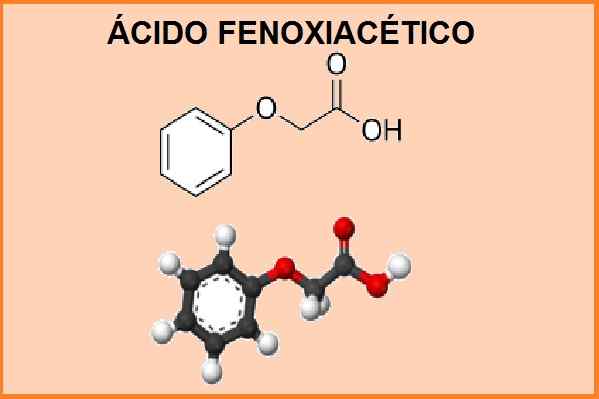
 Estrutura química do ácido fenoxiacético. Fonte: "ácido fenoxiacético". Wikipedia, enciclopédia livre. 13 de maio de 2014, 17:21 UTC. 13 de maio de 2014, 17:21 em.Wikipedia.org. Design de imagem editada.
Estrutura química do ácido fenoxiacético. Fonte: "ácido fenoxiacético". Wikipedia, enciclopédia livre. 13 de maio de 2014, 17:21 UTC. 13 de maio de 2014, 17:21 em.Wikipedia.org. Design de imagem editada. Seu nome químico é 2-fenoxietanóico e sua fórmula molecular é c8 H8 QUALQUER3. A massa molecular é 152,15 g.mol-1. Este produto se comporta como um ácido fraco e tem um ponto de fusão entre 98 e 100 ° C e um ponto de ebulição de 285 ° C.
O ácido fenoxiacético é um produto intermediário na síntese de substâncias com propriedades de herbicida. Por si só, o ácido fenoxiacético tem propriedades antifúngicas Candida Albicans e Trichophyton Rubrum. Também é útil como esfoliativa da pele, eliminando o excesso de queratina em calos.
É necessário ter precauções para manuseio, porque quando aquecido emite gases tóxicos que são corrosivos. Entre os gases está o cloreto de hidrogênio.
A exposição direta com este produto pode causar uma pele leve ou irritação mucosa, embora não seja de grande importância, exceto pela afetação da mucosa ocular, pode ser grave. Também produz irritação do trato respiratório se for inalado e da via gástrica se for ingerido.
É uma substância não -inflamável e bastante estável à temperatura ambiente, no entanto, a altas temperaturas ou pressões, pode perder sua estabilidade e, em face da água, pode liberar uma certa quantidade de energia, mas não o fará violentamente.
[TOC]
Síntese do ácido fenoxiacético
O fenol é um álcool e, como tal, se comporta como um ácido fraco, e é por isso que perde facilmente o próton ácido (H+) em frente a um álcali (hidróxido de sódio) para se tornar um alcoxido (fenolato). Posteriormente, através de uma substituição nucleofílica bimolecular, formará éter.
Pode servir a você: óxido de boro (B2O3): o que é, estrutura, propriedades, usaAlcoxide funciona como um nucleófilo, ou seja, é capaz de desistir de 2 elétrons que são livres para outra substância. No caso da reação em questão, é o halogenídeo alquil (ácido monocloroacético), de tal maneira que se une fortemente através de ligações covalentes a ele, formando uma nova substância que, neste caso, é o éter.
Durante a reação, ocorre um deslocamento do íon halogeneto, que é substituído pelo ânion alcoxido. Esta reação é conhecida como a síntese dos Etheres de Williamson.
A quantidade de produto obtida e a velocidade com que é produzida dependerão da concentração dos reagentes envolvidos, pois essa é uma reação cinética de segunda ordem, onde a colisão das moléculas (nucleófilos + alquil halogenídeo) determina sua eficácia.
Procedimento
Passo 1
Para iniciar a síntese do ácido fenoxiacético, 0,5 gr de fenol é muito cuidadoso e colocado em um frasco em forma de pêra e em uma única boca, com capacidade para 50 ml. 2,5 ml de hidróxido de sódio (NaOH) é adicionado a 33% (p/v) para dissolvê -lo.
Verifique a alcalinidade da solução com um papel indicador de pH. Coloque uma tampa de cortiça no frasco e por 5 minutos se mistura fortemente. Para a mistura, você pode usar um agitador magnético.
Passo 2
Posteriormente, adicione 0,75 g de ácido monocloroacético e repita o procedimento de mistura por 5 minutos.
No caso de a mistura buscar endurecer ou se tornar pastosa, a água pode ser adicionada (entre 1 a 3 ml), mas isso é gradualmente adicionado até que retorne ao contexto anterior, sem diluir muito.
etapa 3
Descubra o balão e coloque -o dentro de um banho de maria que possui um sistema de refluxo por 10 minutos. Se o sistema de fluxo não estiver disponível por 40 minutos.
Passo 4
Deixe a solução esfriar e adicione 5 ml de água, depois acidifique com uma solução HCl concentrada até atingir pH 1. (Meça o pH com um artigo para esse fim).
Pode servir você: cloreto de amônio (NH4Cl)Etapa 5
Passe a mistura cuidadosamente através do funil de separação e remova três vezes, usando 5 ml de éter etílico em cada procedimento.
Um extrato orgânico e substitua no funil de separação para executar uma água triplicada, usando 5 ml de água em cada lavagem.
Frações aquosas são separadas para serem descartadas.
Etapa 6
Posteriormente, a fração orgânica é extraída com 3 ml de carbonato de sódio (NA2Co3) 15% três vezes.
O extrato aquoso alcalino obtido é colocado em banho de gelo e é acidificado com HCl até pH = 1, que gera precipitação do produto. A etapa de acidificação deve ser feita com muito cuidado adicionando queda por queda, porque a reação gera espuma e se for adicionada abruptamente.
O sólido é obtido por filtração a vácuo, o precipitado é lavado e deixado secar.
Etapa 7
O produto obtido está pesando e o desempenho e o ponto de fusão são vistos.
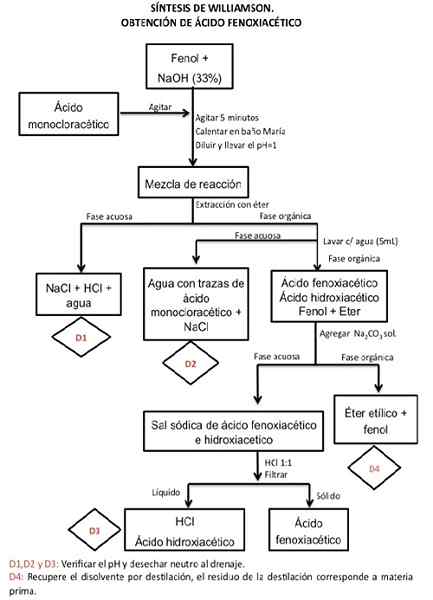 Fonte: Sandoval M. (2015). Manual de Práticas de Laboratório Químico Orgânico II. Universidade Autônoma Nacional do México Faculdade de Química.
Fonte: Sandoval M. (2015). Manual de Práticas de Laboratório Químico Orgânico II. Universidade Autônoma Nacional do México Faculdade de Química. Formulários
Somente o ácido fenoxiacético tem uma atividade fungicida contra certos fungos, como Candida Albicans e Trichophyton Rubrum. Esta ação foi descrita em uma investigação realizada por González e colaboradores.
O trabalho revelou que a concentração inibitória mínima ou fungistática (CMI) e a concentração mínima de fungicida (CMF) foi a mesma (2,5 mg/ml) para 13 espécies de Candida Albicans de amostras clínicas, especificamente de pacientes que sofrem de onicomicose.
Enquanto uma tensão de Candida Albicans O ATCC 10231 apresentou um CMI de 2,5 mg/ml e um CMF de 5,0 mg/ml. Por sua parte, Trichophyton Rubrum apresentou um CMI de 0.313 mg/ml e um CMF de 1.25 mg/ml em 8 cepas analisadas a partir de unhas infectadas.
Além disso, o ácido fenoxiacético é muito útil como esfoliativa da queratina; portanto, é capaz de minimizar calos ou grãos na pele afetada com essas características.
Por outro lado, o ácido fenoxiacético é matéria -prima para síntese de pesticidas, especificamente herbicidas, como Astix e Duposan.
Pode servir a você: ácido sulfeto (H2S): estrutura, propriedades, usos, importânciaRiscos
Se o produto for ingerido acidentalmente, causará irritação das membranas mucosas em todo o trato gastrointestinal (boca, esôfago, estômago e intestino).
Se for inalado, produzirá a irritação da mucosa respiratória, causando insuficiência respiratória e tosse.
Na pele, pode causar leve irritação. Enquanto no olho a irritação da mucosa será mais severa. Nesses casos, é recomendável lavar a área afetada com água e água abundantes.
Este produto tem sido associado como um fator predisponente para a condição ou aparência de tumores adiposos. Esses tumores geralmente se desenvolvem com mais frequência nos membros ou abdômen.
Por outro lado, este produto é classificado como não canalizado para transportar de acordo com os critérios descritos pelos regulamentos de transporte.
Os pesticidas derivados do ácido fenoxiacético se forem geralmente tóxicos para o meio ambiente e foram relacionados a mutações genéticas, especificamente à translocação t presente no linfoma não-hodgkin em humanos.
Precauções
- Este produto deve ser mantido longe de agentes e bases oxidantes fortes que podem reagir violentamente.
- É importante evitar aquecer este produto.
- Manipular usando medidas de proteção, como luvas, vestido, lentes de segurança.
Referências
- González G, Trujillo R. Ácido fenoxiacético, identificação e determinação de sua ação antifúngica Em vitro contra Candida Albicans e Trichophyton Rubrum. Rev. Peruana da Faculdade de Farmácia, 1998; 34 (109). Disponível em: UNMSM.Edu
- "Ácido fenoxiacético". Wikipedia, enciclopédia livre. 13 de maio de 2014, 17:21 UTC. 13 de maio de 2014, 17:21 Wikipedia.org
- Merck Laboratories. Ficha de dados de segurança. 2017. Disponível em: TES.UABC.mx/
- Laboratórios Aventis. Folha de dados de segurança adventis. 2001. Disponível em: Affa.Cl
- Gutiérrez m. Fenoxiacético em emergências toxicológicas. Informações e conselhos de Ciatox Toxox. universidade nacional da Colômbia. Disponível em: Enform.com
- Sandoval m. (2015). Manual de Práticas de Laboratório Químico Orgânico II. Universidade Autônoma Nacional do México Faculdade de Química.
- Merck Laboratories. Folha de dados de segurança de acordo com o regulamento CE no. 1907/2006. 2015 disponível em: ESE.UABC.mx/
- Berzal-Calejo M, Herranz-Torrrumbian A, Cuenca-González C. Tumor adiposo com sintomas de alarme. Rev Clín Med Fam 2015, 8 (3): 246-250. Disponível em: Scielo.ISCIII.É/scielo.
- Matheus T, Bolaños A. Micronúcleos: Biomarcador de Genotoxicidade exposto a pesticidas. Salus, 2014; 18 (2): 18-26. Disponível em: VE.Scielo.org
- « +380 ditados chilenos típicos e populares
- Características do Parque Nacional de Cozumel Arreciphes, Weather, Flora, Fauna »

