Ácido clorico (hclo3)
- 700
- 197
- Lonnie MacGyver
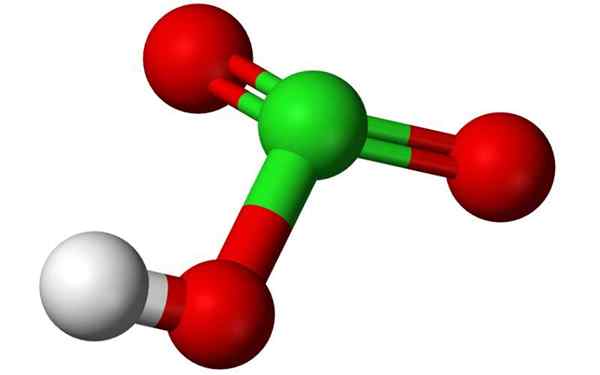
 Estrutura química do ácido clorico em um modelo de balão 3D. Fonte: Benjah-BMM27, Wikimedia Commons
Estrutura química do ácido clorico em um modelo de balão 3D. Fonte: Benjah-BMM27, Wikimedia Commons O que é ácido clorico?
Ele ácido clorico É um composto inorgânico da fórmula HCLO3, um oxácido de cloro e precursor formal de sais de clorato. É um ácido forte capaz de doar um hidrogênio para um aceitador ou base Tronsted.
O composto é obtido com clorato de bário (clorato de barita) com ácido sulfúrico para produzir sulfato de bário, insolúvel em água de acordo com a seguinte reação:
Ba (clo3)2 + H2SW4 → 2HCLO3 + Baso4
Outro método de obtenção é o aquecimento do ácido hipocloroso para obter ácido cloro e cloreto de hidrogênio de acordo com a reação:
3HCLO → HCLO3 + 2hcl
O ácido clorico (HCLO3) é um oxidante poderoso, dado que é capaz de reduzir os estados de oxidação +3, +1 e -1. É usado para a fabricação de sais de clorato.
Se decompõe em concentrações superiores a 30%. Ele também quebra quando aquecido, por isso deve ser mantido frio o tempo todo, e todos os frascos de vidro usados a manusear devem ser refrigerados anteriormente.
Propriedades físicas e químicas
- O ácido clorico existe apenas em solução. É um líquido incolor sem aroma característico.
- O composto tem um peso molecular de 84.459 g/mol e uma densidade de 1 g/ml a 25 ° C.
- Possui um ponto de ebulição maior que 100 ° C e uma solubilidade em água de 40 g por 100 ml deste solvente a 25 ° C.
- O ácido clorico acelerará a queima de materiais combustíveis e pode ativar a maioria em contato. O composto é corrosivo para metais e tecidos.
Pode atendê -lo: coprecipitaçãoAuto-reativo
- As concentrações de ácido clorico acima de 40% se decompõem.
- Sulfeto de antimônio e soluções concentradas de ácido cllórico reagem com incandescência.
- Sulfeto de arsênico e soluções concentradas de ácido clorico reagem com incandescência.
- Reage com vigor, mesmo explode com outros sulfídios de metal, ou seja, sulfeto de cobre.
- Em contato com materiais oxidáveis, incluindo amônia, as reações podem ser extremamente violentas.
- O papel de filtro acende depois de submergi -lo em ácido clorídrico.
- Explosões foram registradas por misturas de solução de ácido clórico com metais como antimônio, bismuto e ferro. Isso se deve à formação de compostos explosivos, incluindo hidrogênio.
Reatividade e perigos
O ácido clorico é um composto instável. Sendo um ácido forte, é extremamente perigoso em caso de contato com a pele (é corrosivo e irritante), contato visual (irritante) e em caso de ingestão. Também isso muito perigoso em caso de inalação.
Uma superexposição severa pode causar danos pulmonares, asfixia, perda de conhecimento ou morte. A exposição prolongada pode causar queimaduras e ulcerações na pele.
A superexposição de inalação pode causar irritação respiratória. A inflamação do olho é caracterizada por vermelhidão, irrigação e coceira. A inflamação da pele é caracterizada por coceira, descascamento, vermelhidão e ocasionalmente, formação de ampolas.
A substância é tóxica para os rins, pulmões e membranas mucosas. A exposição repetida ou prolongada à substância pode causar danos a esses órgãos.
Em caso de contato visual, você deve verificar se as lentes de contato estão sendo usadas e removê -las imediatamente. Os olhos devem ser lavados com água corrente por pelo menos 15 minutos, mantendo as pálpebras abertas. Água fria pode ser usada. Nenhuma lama para os olhos deve ser usada.
Pode atendê -lo: acetonitrila (C2H3N)Se o produto químico entrar em contato com as roupas, retire -as o mais rápido possível, protegendo suas próprias mãos e corpo. Coloque a vítima sob um chuveiro de segurança.
Se o produto químico se acumular na pele exposta da vítima, como as mãos, a pele contaminada com água corrente e sabão não abrasivo é suavemente lavado e cuidadosamente.
Você também pode neutralizar o ácido com hidróxido de sódio diluído ou com uma base fraca, como bicarbonato de sódio. Se a irritação persistir, procure atendimento médico. Lave as roupas contaminadas antes de usá -las novamente.
Se o contato da pele for grave, ele deve ser lavado com um sabão desinfetante e cobrir a pele contaminada com um creme antibacteriano.
Em caso de inalação, a vítima deve permanecer em uma área bem ventilada. Se a inalação for grave, a vítima deve ser evacuada para uma área segura o mais rápido possível.
Roupas apertadas soltas, como pescoço de camisa, cintos ou gravata. Se a vítima é difícil de respirar, o oxigênio deve ser administrado. Se a vítima não está respirando, uma ressuscitação na boca é feita.
Deve -se levar em consideração que pode ser perigoso para a pessoa que fornece ajuda para dar ressuscitação na boca à boca, quando o material inalado é tóxico, infeccioso ou corrosivo.
Em caso de ingestão, não induz vômito. Roupas apertadas soltas, como pescoço de camisa, cintos ou gravatas. Se a vítima não estiver respirando, faça a ressuscitação da boca na boca. Em todos os casos, deve -se procurar atenção médica imediata.
Formulários
O ácido clorico é usado principalmente para a formação de sais de clorato, como sódio, cálcio, magnésio, estrôncio, chumbo, cobre e cloro prateado, bem como o protocloreado e o pecelore de mercúrio são preparados usando o ácido clorico como reagente como reagente como um reagente.
Pode atendê -lo: atividade enzimática: unidade, medição, regulamentação e fatoresPrecursor estável de dióxido de cloro, é usado na produção eletroquímica de amônio de alta pureza.
A principal produção de ácido clorico começou durante a Revolução Industrial na Europa e foi usada para fabricar cloreto de vinil para tubos de PVC.
Outro uso para ácido em inúmeras aplicações em escala menor, incluindo limpeza doméstica, produção de gelatina e outros aditivos alimentares, descalcificação e processamento de couro.
Referências
- Ácido clorico (S.F.). Recuperado de Weebly.com.
- Ácido clorico (S.F.). Recuperado do ChemicalBook.com.

