Ácido carboxílico
- 2961
- 943
- Shawn Leffler
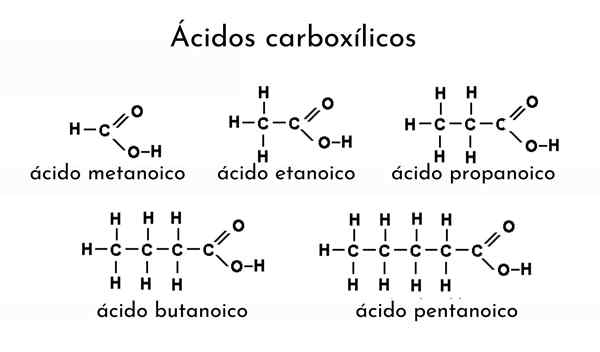
 Exemplos de ácidos carboxílicos
Exemplos de ácidos carboxílicos O que são ácidos carboxílicos?
Ele ácido carboxílico É um termo atribuído a qualquer composto orgânico que contenha um grupo carboxil. Eles também podem ser chamados de ácidos orgânicos e estão presentes em muitas fontes naturais. Por exemplo, de formigas e outros insetos, como besouro de galerita, ácido fórmico, um ácido carboxílico é destilado.
Isto é, um Anthill é uma fonte rica em ácido fórmico. Além disso, o ácido acético é extraído do vinagre, o cheiro de manteiga rançosa é devida a ácido butírico, as ervas da valoria contêm ácido cerebral e das tampas obtidas com ácido caprico, todos esses ácidos carboxílicos.
O ácido lático dá o mau gosto do leite azedo e, em algumas gorduras e óleos, os ácidos graxos estão presentes. Os exemplos de fontes naturais de ácidos carboxílicos são inúmeros, mas todos os nomes designados são derivados de palavras em latim. Assim, em latim, a palavra fórmica significa "formiga".
Como esses ácidos foram extraídos em diferentes capítulos da história, esses nomes eram comuns, consolidando na cultura popular.
Fórmula
O A fórmula geral de ácido carboxílico é -r -cooh, ou mais detalhes: R- (c = o) -oh. O átomo de carbono está ligado a dois átomos de oxigênio, o que causa uma diminuição em sua densidade eletrônica e, consequentemente, uma carga parcial positiva.
Esta carga reflete o status de oxidação do carbono em um composto orgânico. Em qualquer outro, o carbono está tão enferrujado quanto no caso de ácidos carboxílicos, sendo essa oxidação proporcional ao grau de reatividade do composto sendo.
Por esse motivo, o grupo -COOH tem predominância contra outros grupos orgânicos e define a principal natureza carbonatada e a principal cadeia carbonatada do composto.
Portanto, não há derivados ácidos de aminas (R-NH2), mas aminos derivados de ácidos carboxílicos (aminoácidos).
Nomenclatura
Nomes comuns derivados do latim para ácidos carboxílicos não esclarecem a estrutura do composto, ou seu arranjo ou disposição de seus grupos de átomos.
Dada a necessidade desses esclarecimentos, surge a nomenclatura sistemática da IUPAC para nomear ácidos carboxílicos.
Pode atendê -lo: bromo: história, estrutura, configuração eletrônica, propriedades, usosEsta nomenclatura é governada por várias regras, e algumas delas são:
Regra 1
Para mencionar um ácido carboxílico, o nome de seu alcano deve ser modificado adicionando o sufixo "OIC". Assim, para etano (escolha3-CH3) seu ácido carboxílico correspondente é o ácido etanóico (CH3-COOH, ácido acético, o mesmo de vinagre).
Outro exemplo: para Cho3CH2CH2-Cooh el alcano se torna butano (CH3CH2CH2CH3) e, portanto, o ácido butanóico (ácido butírico, o mesmo de manteiga rançosa) é nomeado.
Regra 2
O grupo -cooh define a cadeia principal e o número correspondente a cada carbono é contado de carbonil.
Por exemplo, Cho3CH2CH2CH2-O COOH é o ácido pentanóico, contando de um a cinco carbonos para o metil (escolha3). Se outro grupo metil estivesse ligado ao terceiro carbono, seria CHO3CH2Ch (cap3) CH2-COOH, sendo a nomenclatura resultante agora: ácido 3-metilpentanóico.
Regra 3
Os substituintes são precedidos pelo número de carbono ao qual estão ligados. Da mesma forma, esses substituintes podem ser links duplos ou triplos e adicionar o sufixo "OIC" igualmente a alcenos e alcines. Por exemplo, Cho3CH2CH2Ch = chch2-COOH é mencionado como ácido (cis ou trans) 3- heptenóico.
Regra 4
Quando a cadeia R consiste em um anel (φ). O ácido é mencionado começando com o nome do anel e terminando com o sufixo "carboxílico". Por exemplo, o φ-cooh é nomeado como ácido benzecenocarboxílico.
Estrutura do ácido carboxílico
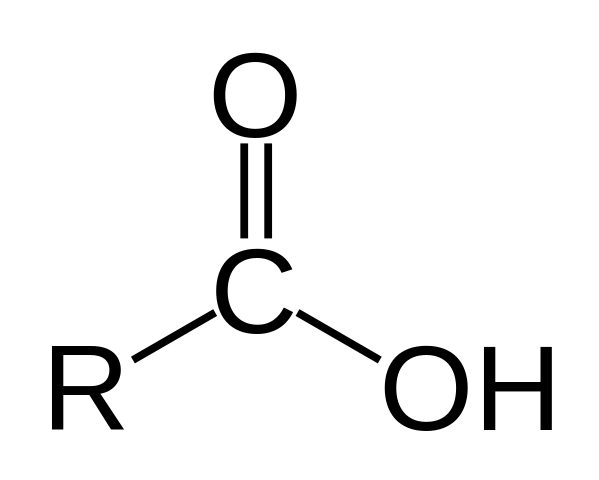 Estrutura de um ácido carboxílico. R é uma cadeia de hidrogênio ou carbonatada.
Estrutura de um ácido carboxílico. R é uma cadeia de hidrogênio ou carbonatada. Na imagem superior, a estrutura geral do ácido carboxílico é representada. A cadeia lateral R pode ter qualquer comprimento ou possuir todos os tipos de substituintes.
O átomo de carbono tem hibridação SP2, que permite que você aceite uma ligação dupla e gera ângulos de link de aproximadamente 120º.
Portanto, esse grupo pode ser assimilado como um triângulo plano. O oxigênio superior é rico em elétrons, enquanto o hidrogênio inferior é pobre em elétrons, tornando -se um hidrogênio ácido (aceitador de elétrons). Isso é observável em estruturas de ressonância de ligação dupla.
O hidrogênio é atribuído a uma base e, por esse motivo, essa estrutura corresponde a um composto ácido.
Pode atendê -lo: aminesPropriedades do ácido carboxílico
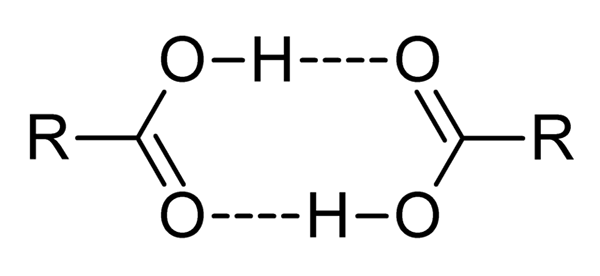
Os ácidos carboxílicos são compostos muito polares, odores intensos e com a facilidade de interagir efetivamente entre si por pontes de hidrogênio, como ilustrado pela imagem superior.
Quando dois ácidos carboxílicos interagem dessa maneira, os dímeros são formados, alguns estáveis o suficiente para existir em uma fase gasosa.
Bridges de hidrogênio e diâmetro fazem com que os ácidos carboxílicos tenham pontos de ebulição mais altos que a água. Isso ocorre porque a energia fornecida no calor deve evaporar não apenas uma molécula, mas para um dímero, também ligada por essas pontes de hidrogênio.
Pequenos ácidos carboxílicos parecem ótima afinidade por solventes de água e polares. No entanto, quando o número de átomos de carbono é maior que quatro, o caráter hidrofóbico das cadeias R predomina e se torna imiscível com a água.
Na fase sólida ou líquida, o comprimento da cadeia R e os substituintes de que ela possui desempenham um papel importante. Assim, quando as correntes são muito longas, elas interagem entre si através das forças de dispersão de Londres, como no caso de ácidos graxos.
Acidez
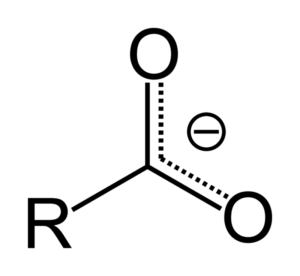
Quando o ácido carboxílico doa um próton, torna -se o ânion carboxilato, representado na imagem superior. Neste ânion, a carga negativa é realocada entre os dois átomos de carbono, estabilizando -o e, portanto, favorecendo a reação de ocorrer.
Como varia essa acidez de um ácido carboxílico para outro? Tudo depende da acidez do próton no grupo OH: os mais pobres em elétrons, mais ácido.
Essa acidez pode ser aumentada se um dos substituintes da cadeia de AR for uma espécie eletronegativa (que atrai ou retira a densidade eletrônica do ambiente).
Por exemplo, se em Cho3-O COOH é substituído um h do grupo metil por um átomo de flúor (CFH2-COOH) A acidez aumenta consideravelmente porque F retira a densidade eletrônica de carbonil, oxigênio e depois hidrogênio. Se todos h forem substituídos por f (cf3-COOH) A acidez atinge seu valor máximo.
Pode atendê -lo: hidrogênio: história, estrutura, propriedades e usosQual variável determina o grau de acidez? O pkpara. Quanto menor o PKpara E mais perto de 1, maior é a capacidade do ácido de se dissociar na água e, por sua vez, mais perigoso e prejudicial. Do exemplo anterior, cf3-COOH tem o menor valor de PKpara.
Usos/aplicações de ácidos carboxílicos
Devido à imensa variedade de ácidos carboxílicos, cada um deles tem uma aplicação em potencial na indústria, seja de polímeros, farmacêuticos ou alimentos.
Indústria de alimentos
- Aditivos.
- Conservantes (ácido sorbico e ácido benzóico).
- Regulador de alcalinidade de muitos produtos.
- Produção de refrigerantes.
- Agentes antimicrobianos antes da ação dos antioxidantes. Nesse caso, a tendência é antimicrobiana líquida.
- Ingrediente principal do vinagre comum (ácido acético).
- Acidulante em bebidas e alimentos carbonatados (ácido cítrico e ácido lático).
- Assistente na maturação do queijo suíço (ácido propiônico).
- Queijo, bufut, colm fermentado e refrigerantes (ácido lático).
Indústria farmacêutica
- Antipirético e analgésico (ácido acetilsalicílico).
- Ativo no processo de síntese de aroma, em alguns medicamentos (ácido butírico ou butanóico).
- Antimicótico (ácido benzóico combinado com ácido salicílico).
- Ativo para a fabricação de medicamentos de vitamina C (ácido ascórbico).
- Fungicida (ácido capímico).
- Fabricação de alguns laxantes (hidroxibotanódio ácido).
Outras indústrias
- Fabricação de plásticos e lubrificantes (ácido sorbico).
- Fabricação de vernizes, resinas elásticas e adesivos transparentes (ácido acrílico).
- Fabricação de pinturas e vernizes (ácido linoléico).
- Fabricação de sabonetes, detergentes, shampoos, cosméticos e produtos de limpeza de metal (ácido oleico).
- Fabricação de massas dentárias (ácido salicílico).
- Produção de acetato de rayon, filmes fotográficos e solventes para tintas (ácido acético).
- Dye e produção bronzeada (ácido metano).
- Preparação de óleos lubrificantes, materiais à prova d'água e pinturas secantes (ácido palmítico).
- Fabricação de borracha (ácido acético).
- Elaboração de borracha e galvanoplastia.
- Solvente.
- Produção de perfumes (ácido benzóico).
- Fabricação de plastificantes e resinas (ácido fotal).
- Elaboração de poliéster (ácido tereftallico).
- Preparação de velas de parafina (ácido esteárico).
Referências
- Graham Solomons t.C., Craig b. Fryhle. Química orgânica. Ácidos carboxílicos e seus derivados (10ª edição., Página 779-783). Wiley Plus.
- Ácidos orgânicos. Naturalwellbeing recuperado.com
- Francis a. Tortoisshell. Quimica Organica. Ácidos carboxílicos. (Sexta edição., Página 805-820). Mc Graw Hill.
- William Reusch. Ácidos carboxílicos. Recuperado da química.MSU.Edu
- « Características e fatores de risco da biodiversidade no México
- Os 5 ramos da biotecnologia principal »

