Estrutura química de ácido bórico, propriedades, preparação, usa

- 1760
- 503
- Orlando MacGyver
Ele ácido bórico É um composto inorgânico cuja fórmula química é h3Bo3. Consiste em um sólido branco ou incolor. É um ácido fraco que em solução aquosa produz, dependendo de sua concentração, um pH entre 3,8 e 4,8. É pouco solúvel em água quente fria e moderadamente solúvel.
O ácido bórico foi descoberto em 1702 por Wilhelm Man.
 Amostra sólida de ácido bórico no vidro do relógio. Fonte: Walkerma via Wikipedia.
Amostra sólida de ácido bórico no vidro do relógio. Fonte: Walkerma via Wikipedia. No entanto, também é apontado que Boerg preparou o ácido bórico adicionando água ao bórax e aquecendo a solução para evaporar, deixando assim no sedimento os cristais de ácido real.
Esse ácido é um composto muito útil que possui inúmeras aplicações na indústria e na medicina, também sendo usadas como inseticida, preservação de madeira, retardando fogo e é um constituinte de uma solução de amortecimento de pH.
[TOC]
Estrutura química
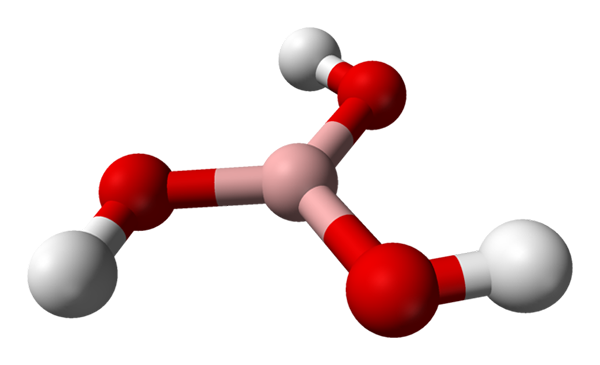 Molécula de ácido bórico representado por um modelo de esferas e barras. Fonte: Benjah-BMM27 [Domínio Público]
Molécula de ácido bórico representado por um modelo de esferas e barras. Fonte: Benjah-BMM27 [Domínio Público] Na imagem superior, temos a própria molécula de H3Bo3. Observe que os átomos de hidrogênio, representados pelas esferas brancos, não estão ligados ao átomo de boro central, como poderia sugerir a fórmula química; mas sim, para átomos de oxigênio, representados por esferas vermelhas.
Assim, uma fórmula mais conveniente, embora menos usada, para o ácido bórico é B (OH)3, indicando que sua acidez é devido a íons h+ Libertado de seus grupos OH. Molecula B (OH)3 Possui uma geometria plana trigonal, com seu átomo de boro tendo uma hibridação química SP2.
O b (oh)3 É uma molécula alta covalente, uma vez que a diferença na eletronegatividade entre o átomo de boro e o oxigênio não é muito grande; Portanto, os links B-O são essenciais covalentes. Observe que a estrutura desta molécula se assemelha à de um spinner. Posso ligar seu próprio eixo da mesma maneira?
Cristais
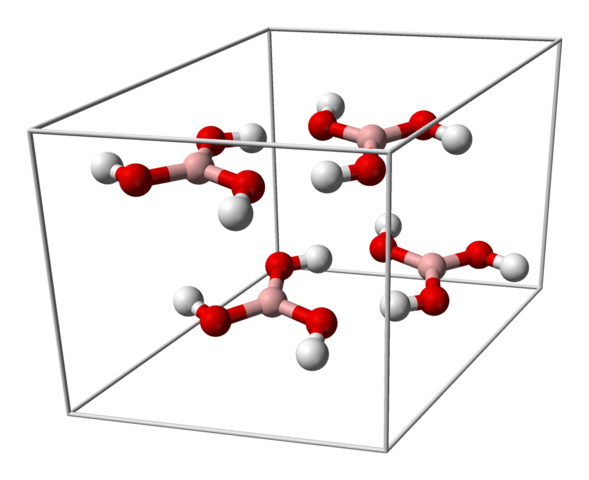 Célula unitária para cristal h3bo3. Fonte: Benjah-BMM27 [Domínio Público]
Célula unitária para cristal h3bo3. Fonte: Benjah-BMM27 [Domínio Público] A imagem superior mostra a célula unitária correspondente à estrutura cristalina do triciciclismo para o ácido bórico que, sob certas condições de síntese, pode adotar a estrutura hexagonal compacta. Observe que existem quatro moléculas por célula unitária e que são ordenadas em duas camadas, A e B, alternadas (elas não são sobrepostas umas sobre as outras).
Devido à simetria e orientação dos links B-OH, pode-se assumir que B (OH)3 É apolar; No entanto, a existência de pontes de hidrogênio intermoleculares muda o histórico. Cada molécula B (OH)3 Para dar ou receber três dessas pontes, com um total de seis interações dipolo-dipolo, como as observadas na imagem abaixo:
Pode atendê -lo: Terpenos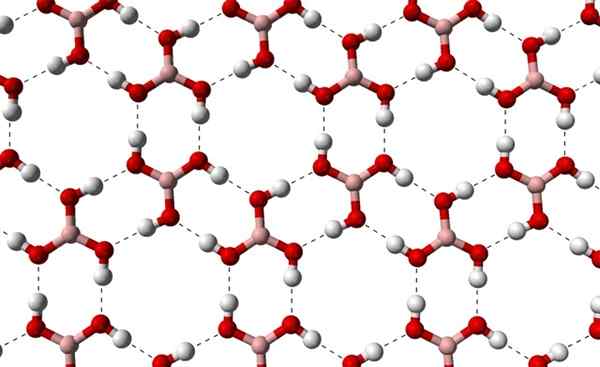 Camadas cristalinas de H3bo3 observadas de um eixo mais alto. Fonte: Benjah-BMM27 [Domínio Público]
Camadas cristalinas de H3bo3 observadas de um eixo mais alto. Fonte: Benjah-BMM27 [Domínio Público] Observe que essas pontes de hidrogênio são as interações direcionais que governam os cristais de ácido bórico e estabelecem padrões de aspectos ornamentais; Anéis internos talvez com espaço suficiente para ocultar algumas impurezas que não estão em defeitos cristalinos.
Essas pontes de hidrogênio, apesar da baixa massa molecular de B (OH)3, Eles mantêm o vidro coeso o suficiente para que ele precise de uma temperatura de 171 ºC para derreter. Não se sabe que efeitos teriam altas pressões (na ordem do GPA) nas camadas moleculares de B (OH)3.
Propriedades
Nomes
IUPAC: ácido bórico e tri -hidrooxidobor. Outros nomes: ácido ortobórico, ácido borracic, sassolito, borofax e tri -hidroxiborano.
Massa molar
61,83 g/mol
Aparência física
Sólido cristalino, incolor e transparente. Também é alcançado como grânulos ou na forma de poeira branca. Um pouco untuoso para tocar.
Cheiro
Lavatório
Sabor
Ligeiramente amargo
Ponto de fusão
170,9 ºC
Ponto de ebulição
300 ºC
Solubilidade em água
Moderadamente solúvel em água fria e solúvel em água quente:
2,52 g/100 ml (0 ºC)
27,50 g/100 ml (100 ºC)
O ácido bórico é parcialmente solúvel em água e tende a afundar nele. Essa solubilidade tende a aumentar na presença de ácidos, como cloridrico, cítrico e tartárico.
Solubilidade em outros solventes
-Glicerol: 17,5 % a 25 ° C
-Etileno glicol: 18,5 % a 25 ° C
-Acetona: 0,6 % a 25 ° C
-Acetato de etila: 1,5 % a 25 ° C
-Metanol: 172 g/l a 25 ºC
-Etanol: 94,4 g/l a 25 ºC
Coeficiente de partição de octanol/água
Log p = -0,29
Acidez (PKA)
9.24. 12.4. 13.3. Estas são as três constantes de suas respectivas dissociações para liberar H+ Na água.
ph
3,8 - 4,8 (3,3 % em solução aquosa)
5.1 (0,1 molar)
Pressão de vapor
1.6 · 10-6 mmhg
Estabilidade
Estável na água
Decomposição
Ele quebra quando é aquecido acima de 100 ºC, formando anidrido e água bóricos.
Reatividade
O ácido bórico forma sais solúveis com cátions monovalentes, por exemplo: Na2B4QUALQUER7.10h2Ou, e sais insolúveis com cátions divalentes, táxi4QUALQUER7.6h2QUALQUER.
Em solução aquosa, produz uma solução ácida, pensando que essa propriedade era devido à subtração de grupos de OH- da água. O ácido bórico é qualificado como um ácido fraco do tipo Lewis.
O ácido bórico reage com glicerol e manitol, aumentando a acidez do ambiente aquoso. A PKA é modificada de 9,2 a 5, devido à formação de boro-manitol Quelato [BC6H8QUALQUER2(OH)2]-, que libera h+.
Preparação
O ácido bórico está em estado livre em emanações vulcânicas em regiões como a Toscana da Itália, as ilhas Lipari e no estado de Nevada, EUA. Também é encontrado em minerais como Borax, Boracita, Ulexita e Colemanita.
Pode atendê -lo: halogêniosO ácido bórico é preparado principalmente pela reação do mineral de bórax (tetraborato de sódio de sódio) com ácidos minerais, como ácido clorídrico, ácido sulfúrico, etc.
N / D2B4QUALQUER9· 10h2O +hcl => 4 h3Bo3 + 2 NaCl +5 h2QUALQUER
Também é preparado através da hidrólise de Boro e Diborano Trihaluro.
O ácido bórico é preparado a partir de Collemanite (CA2B6QUALQUERonze· 6 h2QUALQUER). O procedimento consiste no tratamento do mineral com ácido sulfúrico para dissolver compostos de boro.
Então, a solução em que o ácido bórico dos fragmentos desenrolados está presente é separado. A solução de sulfeto de hidrogênio é tratada para precipitar as impurezas do arsênico e ferro. O sobrenadante é resfriado para produzir um precipitado de ácido bórico e separá -lo da suspensão.
Formulários
Na indústria
O ácido bórico é usado na elaboração de fibra de vidro. Ao contribuir para reduzir o ponto de fusão, aumenta a força e a eficiência da fibra de vidro têxtil: material usado para reforçar o plástico usado em vasos, tubos industriais e placas de circuitos de computador.
O ácido bórico participa da fabricação de vidro borossilizado, que permite obter um vidro resistente a vidro, utilizável na culinária doméstica, no material de vidro de laboratórios, tubos fluorescentes, fibra óptica, telas de LCD, etc.
É usado na indústria metalúrgica para endurecer e tratar ligas de aço, além de favorecer o revestimento de metal dos materiais.
É usado como um componente químico em fraturamento hidráulico (fracking): método usado na extração de petróleo e gás. O ácido bórico atua como um retardador de incêndio em materiais de celulose, plásticos e têxteis que são impregnados com ácido bórico para aumentar sua resistência ao fogo.
Em medicina
O ácido bórico é usado diluído na lavagem dos olhos. As cápsulas de gelatina de ácido bórico são usadas para o tratamento de infecções fúngicas, especialmente Candida albicans. Também tem sido usado no tratamento da acne.
O ácido bórico é polvilhado em meias para prevenir infecções por pés, como o pé do atleta. Da mesma forma, soluções contendo ácido bórico são usadas no tratamento de otite externa em humanos, bem como em animais.
O ácido bórico é adicionado nas garrafas usadas para coleta de urina, que impede a contaminação bacteriana antes de ser examinada em laboratórios de diagnóstico.
Pode atendê -lo: ácido indolalético: estrutura, propriedades, obtenção, usoInseticida
O ácido bórico é usado no controle da proliferação de insetos, como baratas, cupins, formigas etc. As baratas não matam instantaneamente, pois afeta primeiro seus sistemas digestivos e nervosos, além de destruir seu exoesqueleto.
O ácido bórico exerce sua ação lentamente, permitindo que os insetos que o ingeriram entrem em contato com outros insetos, espalhando o envenenamento.
Preservação
O ácido bórico é usado para impedir o ataque de madeira por fungos e insetos, usando para esse fim em conjunto com o etileno glicol. Este tratamento também é eficaz no controle de lodo e algas.
Amortecedor de pH
O ácido bórico e sua base conjugada formam um sistema de amortecimento da PKA = 9,24, o que indica que esse amortecedor tem sua maior eficácia ao pH alcalino, que não são comuns nos seres vivos. No entanto, o absorvedor de choque de borato é usado na regulação do pH em piscinas.
Reatores nucleares
O ácido bórico tem a capacidade de capturar nêutrons térmicos, o que reduz a possibilidade de fissão nuclear não controlada que pode produzir acidentes nucleares.
Agricultura
Boro é um elemento essencial para o crescimento da planta, que induziu o uso de ácido bórico para a contribuição do elemento. No entanto, no excesso de ácido bórico pode danificar as plantas, especialmente frutas cítricas.
Contra -indicações
O uso de ácido bórico na pele desnudada, ferida ou produto queimado que permite a absorção do mesmo deve ser evitado. Este é um composto tóxico dentro do corpo e, em alguns casos, pode causar desmaio, convulsões, espasmos, tiques faciais e hipotensão arterial.
O médico deve ser consultado para o uso de cápsulas vaginais de ácido bórico em mulheres grávidas, pois foi apontado que as deformações fetais e uma diminuição no peso corporal da criança no nascimento podem produzir no nascimento.
A colocação do ácido bórico, usado como inseticida, em lugares disponíveis para crianças, uma vez que as crianças têm uma maior suscetibilidade à ação tóxica do ácido bórico, estabelecendo nelas a dose fatal em 2.000 a 3.000 mg.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2019). ÁCIDO BÓRICO. Recuperado de: em.Wikipedia.org
- Centro Nacional de Informações sobre Biotecnologia. (2019). ÁCIDO BÓRICO. Banco de dados PubChem. CID = 7628. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Os editores da Enyclopaedia Britannica. (28 de março de 2019). ÁCIDO BÓRICO. Encyclopædia britannica. Recuperado de: Britannica.com
- Transportadora vibrando. (9 de novembro de 2018). Os usses ocultos de ácido bórico em sua vida diária. Recuperado de: CarrierVibrating.com
- Centro Nacional de Informação de Pesticidas. (s.F.). ÁCIDO BÓRICO. Recuperado de: npic.Orst.Edu
- Elaboração. (30 de novembro de 2017). Ácido bórico: propriedades e usos deste composto químico. Recuperado de: ácidos.Informações
- Clorurosódio. (2019). Ácido bórico. Recuperado de: clorurosodium.com
- Sociedade Espanhola de Farmácia do Hospital. (s.F.). Ácido bórico. [PDF]. Recuperado de: grupos de trabalho.Sefh.é
- « Comparador óptico de qual é o uso e peças
- 11 Benefícios da reciclagem na sociedade (com exemplos) »

