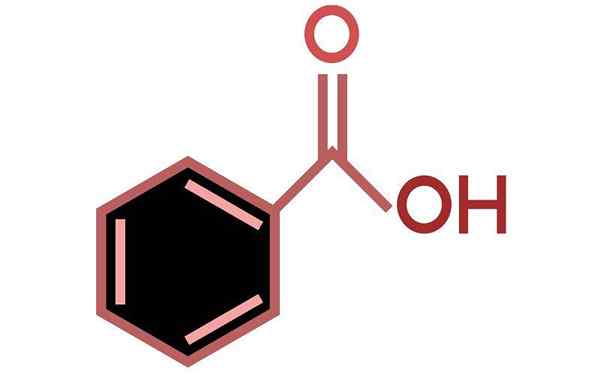
Ácido benzóico (C6H5cooh)
- 2495
- 675
- Tim Mann
 O ácido benzóico é um ácido carboxílico aromático
O ácido benzóico é um ácido carboxílico aromático O que é ácido benzóico?
Ele Ácido benzóico É o ácido aromático mais simples de todos, tendo como fórmula molecular C6H5COOH. Na natureza, é encontrado em inúmeras plantas, especialmente em frutas como damasco e mirtilo. Também ocorre nas bactérias como subproduto do metabolismo de fenilalanina de aminoácidos.
É gerado no intestino pelo processamento bacteriano (oxidativo) dos polifenóis presentes em alguns alimentos.
O C6H5O COOH é, diferentemente de muitos ácidos, um composto sólido, consistindo em cristais leves, brancos e filiformes, que emitem uma amêndoa e aroma característico.
Uma das principais capacidades do ácido benzóico é inibir o crescimento de fermento, mofo e algumas bactérias, por isso é usado como conservante alimentar.
Embora não seja um composto especialmente tóxico, possui algumas ações prejudiciais para a saúde. Portanto, quem recomenda uma dose máxima de ingestão de 5 mg/kg de peso corporal/dia, equivalente a uma ingestão diária de 300 mg de ácido benzóico.
Estrutura do ácido benzóico
 Estrutura do ácido benzóico. Fonte: Wikimedia Commons
Estrutura do ácido benzóico. Fonte: Wikimedia Commons A imagem superior representa a estrutura do ácido benzóico em um modelo de barra e esferas.
Se o número de esferas pretas forem contadas, será verificado que existem seis delas, ou seja, seis átomos de carbono, duas esferas vermelhas correspondem aos dois átomos de oxigênio do grupo carboxil, -cooh e, finalmente, as esferas brancas são os átomos de hidrogênio.
À esquerda, você tem o anel aromático, cuja aromaticidade é ilustrada com as linhas descontínuas no centro do anel. E à direita, o grupo -cooh, responsável pelas propriedades ácidas deste composto.
Molecularmente, o C6H5O COOH tem uma estrutura plana, porque todos os seus átomos (exceto hidrogênios) têm hibridação de SP2.
Por outro lado, o grupo -cooh, altamente polar, permite que um dipolo permanente exista na estrutura.
Este fato resulta no C6H5O COOH pode interagir consigo mesmo através das forças dipolo-dipolo. Especificamente, com pontes especiais de hidrogênio.
Se o grupo -COOH for observado, será descoberto que o oxigênio do C = O pode aceitar uma ponte de hidrogênio, enquanto o oxigênio o -h doa -o.
Pontes de cristal e hidrogênio
O ácido benzóico pode formar duas pontes de hidrogênio: recebe e aceita uma simultaneamente. Portanto, está formando dímeros, ou seja, sua molécula está "relacionada" com outro.
Estes são pares ou dímeros, C6H5COOH-HOOCC6H5, a base estrutural que define o sólido resultante de seu planejamento no espaço.
Pode atendê -lo: elementos diatômicosPropriedades físicas e químicas do ácido benzóico
Nomes químicos
Ácido:
-Benzóico
-Benzenocarboxílico
-Dracyl
-Carboxibenzeno
-Benzenoforêmico
Fórmula molecular
C7H6QUALQUER2 ou c6H5COOH
Peso molecular
122.123 g/mol.
Descrição física
Sólido ou na forma de cristais, geralmente branco, mas pode apresentar uma cor bege se abrigar certas impurezas. Seus cristais são esquemas ou em forma de agulha.
Cheiro
Cheira a amêndoas e é bom.
Sabor
Sem gosto ou um pouco amargo. O limite de detecção de sabor é de 85 ppm.
Ponto de ebulição
480º F a 760 mmHg (249 ºC).
Ponto de fusão
252,3º F (121,5-123,5 ºC).
ponto de ignição
250º F (121 ºC).
Sublimação
Pode sublimalizar a partir dos 100 ºC.
Solubilidade em água
3,4 g/l a 25 ºC.
Solubilidade em solventes orgânicos
- 1 g de ácido benzóico se dissolve em um volume igual a: 2,3 ml de álcool frio, 4,5 ml de clorofórmio, 3 ml de éter, 3 ml de acetona, 30 ml de tetracloreto de carbono, 10 ml de benzeno, 30 ml de dissulfeto de carbono, e 2,3 ml de óleo Treem.
- Também é solúvel em óleos voláteis e fixos.
- É levemente solúvel em éter de petróleo.
- Sua solubilidade em Hexano é de 0,9 g/L, em metanol 71,5 g/L, e em tolueno 10,6 g/l.
Densidade
1.316 g/ml a 82,4º F e 1.2659 g/ml a 15 ° C.
Densidade de vapor
4,21 (com relacionamento aéreo tomado como referência = 1)
Pressão de vapor
1 mmHg a 205º F e 7,0 x 10-4 mmhg a 25 ºC.
Estabilidade
Uma solução com uma concentração de 0,1% na água é estável por pelo menos 8 semanas.
Decomposição
Se decompõe aquecendo, emitindo um hectare e fumaça irritante.
Gosma
1,26 cPoise a 130 ºC.
Calor de combustão
3227 KJ / mol.
Calor de vaporização
534 kJ /mol a 249 ºC.
ph
Cerca de 4 na água.
Tensão superficial
31 n/m a 130 ºC.
Pka
4.19 a 25 ºC.
Índice de refração
1.504-1.5397 (ηd) a 20 ºC.
Reações
- Em contato com as bases (Naoh, Koh, etc.) Formar vendas de benzoat. Por exemplo, se você reagir com o NaOH, forma de benzoato de sódio, c6H5Caminho.
- Reage com álcoois para formar ésteres. Por exemplo, sua reação ao álcool etílico origina o éster etílico. Alguns ésteres de ácido benzóico cumprem a função como plastificantes.
- Reage com pentacloreto de fósforo, PCL5, Para formar cloreto de Benzoil, um halogeneto ácido. O cloreto de benzoil pode reagir com amônio (NH3) ou uma amina como metilamina (CHO3NH2) Para formar benzamida.
- A reação do ácido benzóico com ácido sulfúrico produz sulfonação do anel aromático. O grupo funcional -so3H substitui um átomo de hidrogênio na posição alvo do anel.
Pode atendê -lo: Primeira Revolução da Química- Pode reagir com ácido nítrico, com o uso de ácido sulfúrico como catalisador, formando meta-nitrobenzóico ácido.
- Na presença de um catalisador, como cloreto férrico, FECL3, O ácido benzóico reage com halogênios. Por exemplo, ele reage com cloro para a formação de ácido meta-clorobenzóico.
Produção
Alguns métodos de produção deste composto:
- A maior parte do ácido benzóico ocorre industrialmente, oxidando o tolueno com o oxigênio presente no ar. O processo é catalisado por gasolina de cobalto, a uma temperatura de 140-160 ºC e a uma pressão 0,2-0,3 MPa.
- O tolueno pode clorar para produzir benzotricídeo, que é subsequentemente hidrolisado com ácido benzóico.
- A hidrólise de benzonitrila e benzamida, em meio ácido ou alcalino, pode causar ácido benzóico e suas bases conjugadas.
- Álcool benzílico em uma oxidação mediada por permanganato de potássio, em um meio aquoso, produz ácido benzóico. A reação ocorre pela destilação de aquecimento ou refluxo. Depois que o processo é concluído, a mistura é filtrada para remover dióxido de manganês, enquanto o sobrenadante é resfriado para obter ácido benzóico.
- O composto de benzocticloro está reagindo com hidróxido de cálcio, usando sais de ferro ou ferro como catalisadores, formando inicialmente o benzoato de cálcio, CA (C (C (C6H5COO)2. Então esse sal, por reação com ácido clorídrico, é convertido em ácido benzóico.
O ácido benzóico usa
Industriais
- É usado na produção de fenol por descarboxilação oxidativa do ácido benzóico a temperaturas de 300-400 ºC, porque o fenol pode ser usado na síntese do nylon.
- A partir dele, o benzoato glicol, precursor químico do éster dietileno glicol e o éster de trietileno glicol, substâncias usadas como plastificantes. Talvez a aplicação mais importante de plastificantes sejam formulações adesivas. Alguns ésteres de cadeia longa são usados para suavizar plásticos, como o PVC.
- É usado como ativador da polimerização de borracha. Além disso, é um intermediário na fabricação de resinas alquídicas, bem como aditivos para aplicações na recuperação de petróleo bruto.
- Além disso, é usado na elaboração de resinas, corantes, fibras, pesticidas e como um agente modificador da resina de poliamida para produção de poliéster. É usado para manutenção de aroma de tabaco.
Pode atendê -lo: sais binários- É um precursor do cloreto de Benzoil, que é um material de partida para a síntese de compostos como o benzoato de benzil, usado na elaboração de sabores artificiais e insetos de insetos.
Medicinal
- É um componente do Whitfield Oint. Esta pomada é composta por 6% de ácido benzóico e 3% de ácido salicílico.
- É um ingrediente da tintura benzoína, usada como inalando anti -sépticos tópicos e descongestionados. Foi usado como expectorante, analgésico e anti -séptico até o início do século XX.
- O ácido benzóico tem sido utilizado na terapia experimental de pacientes com doenças de acumulação de nitrogênio residual.
Conservação de Alimentos
- O ácido benzóico e seus sais são usados na conservação de alimentos. O composto é capaz de inibir o crescimento de mofo, levedura e bactérias, através de um mecanismo dependente de pH.
Inconveniente
Pode reagir com ácido ascórbico (vitamina C) presente em algumas bebidas, produzindo benzeno, composto de carcinogênio. Por causa disso, outros compostos estão sendo procurados com a capacidade de conservar alimentos que não apresentam os problemas do ácido benzóico.
Outros
- É usado em uma embalagem ativa, sendo presente em ionômeros. A partir deles, o ácido benzóico é liberado, capaz de inibir o crescimento de espécies de gêneros Penicillium e Aspergillus Em meios microbianos.
- É usado como um agente conservante do aroma de suco de frutas e perfumes.
- O ácido benzóico é usado como um herbicida seletivo para controlar ervas daninhas com larguras e gramíneas em feijão, pepino, melão, amendoim e plantas ornamentais lenhosas.
Toxicidade
- Em contato com a pele e os olhos, ela pode produzir vermelhidão. Pela inalação pode causar irritação do respiratório e tosse. A ingestão de grandes quantidades de ácido benzóico pode causar distúrbios gastrointestinais, sendo capaz de atingir o fígado e os danos renais.
- Ácido benzóico e benzoatos podem liberar histamina que pode causar reações alérgicas e irritação de olhos, pele e membranas mucosas.
- Falta efeito cumulativo, mutagênico ou carcinogênico, pois é rapidamente absorvido no intestino, eliminando a urina sem se acumular no corpo.
- A dose máxima permitida de acordo com a OMS é 5 mg/kg de peso corporal/dia, aproximadamente 300 mg/dia. Dose de toxicidade aguda em humanos: 500 mg/kg.
Referências
- Ácido benzóico. Recuperado do ChemicalBook.com
- Ácido benzóico. Recuperado de PubChem.NCBI.Nlm.NIH.Gov
- Ácido benzóico. Recuperado de.Wikipedia.org

