Estrutura de carboneto de cálcio (CAC2), propriedades, obtenção, uso

- 4070
- 170
- Dennis Heidenreich
Ele Carboneto de cálcio É um composto inorgânico formado por elementos de cálcio (CA) e carbono (c) (c). Sua fórmula química é CAC2. É um sólido que pode ser incolor para branco e acinzentado, e até preto, dependendo das impurezas que ele contém.
Uma de suas reações químicas mais importantes do CAC2 é aquele que ocorre com a água h2Ou, no qual HCidor acetileno se forma. Portanto, é usado para obter acetileno industrialmente. Devido à mesma reação da água, é usado para amadurecer frutas, em canhões falsos e em explosões navais.
 Carboneto de cálcio CAC2 sólido. Ondřej MANGL / PUB DOMAIN. Fonte: Wikimedia Commons.
Carboneto de cálcio CAC2 sólido. Ondřej MANGL / PUB DOMAIN. Fonte: Wikimedia Commons. A reação do CAC2 Com a água também produz uma lama útil para preparar o clínico (um componente de cimento), que produz menos dióxido de carbono (CO2) Se comparado ao método tradicional de produzir cimento.
Com nitrogênio (n2) O carboneto de cálcio forma a cianamida de cálcio, que é usada como fertilizante. O CAC2 Também é usado para remover o enxofre de certas ligas de metal.
Algum tempo atrás, o CAC2 Foi usado nas lâmpadas de carboneto tão chamadas, mas elas não são mais muito comuns porque são perigosas.
[TOC]
Estrutura
O carboneto de cálcio é um composto iônico e é formado pela CA Calcio ion2+ e o carboneto ou acetiluro C22-. O íon de carboneto é composto por dois átomos de carbono unidos por uma ligação tripla.
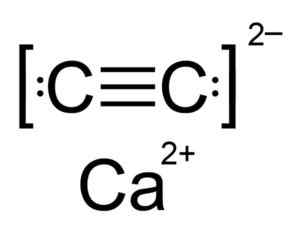 Estrutura química do carboneto de cálcio. Autor: Hellbus. Fonte: Wikimedia Commons.
Estrutura química do carboneto de cálcio. Autor: Hellbus. Fonte: Wikimedia Commons. A estrutura cristalina do CAC2 É derivado do cúbico (como NaCl de cloreto de sódio), mas como o íon c22- A estrutura é alongada é distorcida e gira tetragonal.
Nomenclatura
- Carboneto de cálcio
- Carboneto de cálcio
- Acetilura de cálcio
Propriedades
Estado físico
Sólido cristalino que, quando puro, é incolor, mas se estiver contaminado com outros compostos, pode ser amarelado ou acinzentado a preto.
 Carboneto de cálcio CAC2 Com impurezas. LEIEM/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0). Fonte: Wikimedia Commons.
Carboneto de cálcio CAC2 Com impurezas. LEIEM/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0). Fonte: Wikimedia Commons. Peso molecular
64.0992 g/mol
Pode atendê -lo: Alilo: unidade allyic, carbocalização, radical, exemplosPonto de fusão
2160 ºC
Ponto de ebulição
O CAC2 ferve a 2300 ºC com decomposição. O ponto de ebulição deve ser medido sob atmosfera inerte, isto é, sem oxigênio ou umidade.
Densidade
2,22 g/cm3
Propriedades quimicas
O carboneto de cálcio reage com a água para formar hccer acetileno e hidróxido de cálcio CA (OH)2:
CAC2 + 2 h2O → HCidor + Ca (OH)2
O acetileno é inflamável, portanto, na presença de umidade, o CAC2 Pode ser inflamável. No entanto, quando está seco, não é.
 Carboneto de cálcio CAC2 Com a forma de água hc hoch acetileno, composto inflamável. Kristina Kravets/CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons.
Carboneto de cálcio CAC2 Com a forma de água hc hoch acetileno, composto inflamável. Kristina Kravets/CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons. O carboneto de cálcio reage com nitrogênio n2 Para formar canamida de cacnio cacn2:
CAC2 + N2 → CACN2 + C
Obtenção
O carboneto de cálcio é produzido industrialmente em um forno de arco elétrico com base em uma mistura de carbonato de cálcio (Caco3) e carvão (c) que é enviado a uma temperatura de 2000 ° C. A reação está resumida da seguinte forma:
Ladrão3 + 3 C → CAC2 + Co ↑ + co2↑
Ou também:
Cao + 3 C → CAC2 + Co ↑
Em um forno de arco elétrico, há um arco de eletricidade entre dois eletrodos de grafite, que resistem às altas temperaturas que são formadas. Um carboneto de cálcio com 80-85% de pureza é obtido.
Formulários
Na produção de acetileno
Industrialmente, a reação de carboneto de cálcio com água para produzir acetileno C é usada2H2.
CAC2 + 2 h2O → HCidor + Ca (OH)2
Este é o uso mais importante do carboneto de cálcio. Em alguns países, o acetileno é muito apreciado, pois permite produzir cloreto de polivinil, que é um tipo de plástico. Além disso, o acetileno serve para realizar soldas a altas temperaturas.
 Metais de chama de acetileno HCCH em temperaturas muito altas. Autor: ShutterBug75. Fonte: Pixabay.
Metais de chama de acetileno HCCH em temperaturas muito altas. Autor: ShutterBug75. Fonte: Pixabay. Na redução de emissões de coes2
Os restos obtidos da obtenção de acetileno a partir do CAC2 (também chamado de "lodo de carboneto de cálcio" ou "resíduos de carboneto de cálcio") Eles servem para serem usados na obtenção de clínquer ou concreto.
Pode atendê -lo: aplicações tecnológicas da emissão eletrônica de átomosA lama de carboneto de cálcio tem um alto teor de hidróxido de cálcio (CA (OH)2) (cerca de 90%), algum carbonato de cálcio (caco3) e tem um pH maior que 12.
 Os resíduos de carboneto de cálcio podem ser usados na atividade de construção para preparar o concreto, reduzindo assim a geração de CO2 da referida indústria. Autor: Engin Akyurt. Fonte: Pixabay.
Os resíduos de carboneto de cálcio podem ser usados na atividade de construção para preparar o concreto, reduzindo assim a geração de CO2 da referida indústria. Autor: Engin Akyurt. Fonte: Pixabay. Por esses motivos, você pode reagir com o SIO2 ou al2QUALQUER3 formando um produto semelhante ao obtido pelo processo de hidratação do cimento.
Uma das atividades humanas que produz mais emissões2 É a indústria da construção. O co2 É gerado a leste do carbonato de cálcio durante a reação para formar concreto.
Usando lama de carboneto de cálcio para substituir carbonato de cálcio (caco3) Verificou -se que as emissões são reduzidas2 Em 39%.
Na obtenção de cianamida de cálcio
O carboneto de cálcio também é usado industrialmente para obter CACN de cianamida de cálcio2.
CAC2 + N2 → CACN2 + C
A cianamida de cálcio tem uso como fertilizante, porque com a água do solo se torna cianamida h2n = c = n, que fornece nitrogênio às plantas, um nutriente essencial para estes.
Na indústria metalúrgica
O carboneto de cálcio é usado para remover ligas como Ferroníquel. O CAC está misturado2 Com a liga fundida a 1550 ° C. O enxofre (s) reage com carboneto de cálcio e sulfeto de cálcio CAS e carvão C:
CAC2 + S → 2 C + CAS
A remoção de enxofre é favorecida se a mistura for eficiente e o teor de carbono em liga estiver baixo. O sulfeto de cálcio de casclium flutua na superfície da liga fundida onde opta e descartada.
Em vários usos
O carboneto de cálcio tem sido usado na eliminação de enxofre de ferro. Também como combustível na produção de aço e como um poderoso desoxidante.
Pode servir a você: Substituição eletrofílica aromática: mecanismo e exemplosÉ usado para amadurecer frutas. Do carboneto de cálcio com água, é gerado acetileno, o que induz a maturação de frutas, como bananas.
 Bananas podem amadurecer usando carboneto de cálcio CAC2. Autor: Alexas Fotos. Fonte: Pixabay.
Bananas podem amadurecer usando carboneto de cálcio CAC2. Autor: Alexas Fotos. Fonte: Pixabay. O carboneto de cálcio é usado em canhões falsos para causar o barulho alto de explosão que os caracteriza. Aqui também é usada formação de acetileno, que explode com uma faísca dentro do artefato.
O CAC2 É usado para gerar sinais no alto mar em explosões navais que auto -considerem.
Uso descontinuado
O CAC2 Foi usado nas lâmpadas de carboneto de som. A operação destes consiste em pingar água no carboneto de cálcio para formar acetileno, que liga e, portanto, fornece luz.
Essas lâmpadas foram usadas em minas de carvão, mas seu uso foi descontinuado devido à presença de metano a gás4 Nessas minas. Este gás é inflamável e a chama da lâmpada de carboneto pode fazê -la disparar ou explorar.
 Lâmpada de carboneto de cálcio CAC2. Domínio Scehardt / pub. Fonte: Wikimedia Commons.
Lâmpada de carboneto de cálcio CAC2. Domínio Scehardt / pub. Fonte: Wikimedia Commons. Eles foram amplamente utilizados em minas de rochas ardósia, cobre e lata, e também nos primeiros carros, motocicletas e bicicletas, como luzes frontais ou faróis.
Eles foram atualmente substituídos por lâmpadas elétricas ou até lâmpadas LED. No entanto, eles ainda são usados em países como a Bolívia, nas minas de prata de Potosí.
Riscos
Carboneto de cálcio CAC2 seco não é inflamável, mas na presença de umidade forma acetileno, o que é.
Para extinguir um incêndio na presença de CAC2 Água, espuma, dióxido de carbono ou extintores de halogênio nunca devem ser usados. Hidróxido de sódio ou cálcio deve ser usado.
Referências
- ROPP, r.C. (2013). Grupo 14 (C, SI, GE, SN e PB) compostos alcalinos da terra. Carbonetos de cálcio. Na enciclopédia dos compostos da Terra Alcalina. Recuperado de cientedirect.com.
- Pohanish, r. P. (2017). C. Cálcio de carboneto. No manual de produtos químicos tóxicos e perigosos de Sittig e carcinágenos (sétima edição). Recuperado de cientedirect.com.
- Sol, h. et al. (2015). Propriedades de reimes de carboneto de cálcio combinado quimicamente e sua infecção nas propriedades de cimento. Materiais 2015, 8, 638-651. NCBI se recuperou.Nlm.NIH.Gov.
- Nie, Z. (2016). Eco-materiais e avaliação do ciclo de vida. Estudo de caso: CO2 Análise de emissão do clínico de lodo de carboneto de cálcio. Em Green and Sustainable Manufacturing of Advanced Material. Recuperado de cientedirect.com.
- Crundwell, f.K. Et al. (2011). Refinando Ferronickel derretido. Remoção de enxofre. Na metalurgia extrativa de níquel, cobalto e metais do grupo de platina. Recuperado de cientedirect.com.
- Tressler, r.E. (2001). Cerâmica estrutural e termmoestrutural. Carbonetos. Na enciclopédia da ciência e tecnologia de materiais. Recuperado de cientedirect.com.
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- « 10 benefícios da corrida diária para a saúde
- Valores morais características, treinamento e exemplos »

