Carbono

- 3713
- 36
- Pete Wuckert
O que é carbono?
Ele carbono É um elemento químico não -metálico cujo símbolo químico é C. Seu nome é devido a carvão, vegetal ou mineral, onde seus átomos definem várias estruturas. Ele forma uma ampla gama de compostos orgânicos e inorgânicos e também se apresenta em um número considerável de artes.
O carbono é encontrado em todos os seres vivos; Todas as suas biomoléculas devem sua existência à estabilidade e força das ligações C-C e sua alta tendência a concatenar. É o elemento da vida e, com seus átomos, seus corpos são construídos.
Os compostos orgânicos com os quais os biomateriais são construídos consistem em esqueletos carbonatados e heteroatomos. Estes podem ser vistos à primeira vista na madeira das árvores; E também, quando o raio cai sobre eles e Rostiza. O sólido preto inerte restante também possui carbono; Mas é um carvão vegetal.
Propriedades de carbono
As propriedades físicas ou químicas encontradas em sólidos, minerais ou materiais carbonáceos estão sujeitos a muitas variáveis. Entre eles estão: a composição ou grau de impurezas, as hibridações dos átomos de carbono, a diversidade das estruturas e a morfologia ou tamanho dos poros.
Quando as propriedades do carbono descrevem, a maioria dos textos ou fontes bibliográficos é baseada em grafite e diamante.
Porque? Porque eles são os mais conhecidos, para este elemento e representam sólidos ou materiais de alta pureza; isto é, eles praticamente são feitos nada além de átomos de carbono (embora com estruturas diferentes, como será explicado na seção a seguir).
As propriedades do carvão vegetal e mineral diferem em suas origens ou composições, respectivamente. Por exemplo, linhita (pobre carbono) como combustível de gatea em comparação com antracite (rico em carbono). E o que dizer sobre os outros muitos: nanotubos, fulerenos, grafeno, graphos, etc.
No entanto, eles têm um ponto comum: eles oxidam com um excesso de oxigênio em CO2:
C + QUALQUER2 => Co2
Agora, a velocidade ou a temperatura que eles precisam para oxidar são próprios para cada um deles.
Grafite vs diamante
Aqui também serão feitos um breve comentário sobre as diferentes propriedades para esses dois muitos:
 Tabela em que algumas propriedades dos dois amores cristalinos de carbono são comparados. Fonte: Gabriel Bolívar.
Tabela em que algumas propriedades dos dois amores cristalinos de carbono são comparados. Fonte: Gabriel Bolívar. Estrutura e configuração eletrônica
Hibridações
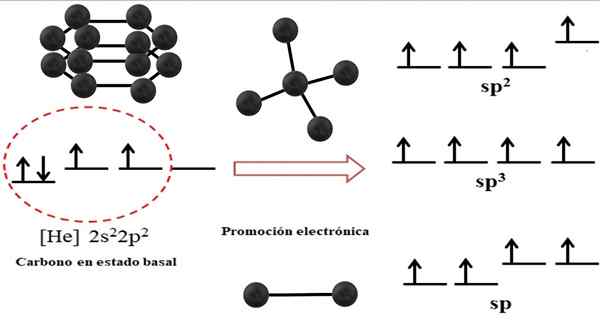 Relação entre orbitais híbridos e possíveis estruturas para carbono. Fonte: Gabriel Bolívar.
Relação entre orbitais híbridos e possíveis estruturas para carbono. Fonte: Gabriel Bolívar. A configuração eletrônica para o átomo de carbono é 1s22s22 p2, também escrito como [ele] 2s22 p2 (Imagem superior). Esta representação corresponde ao seu status basal: o átomo de carbono isolado e suspenso em um vácuo que não pode interagir com os outros.
Pode atendê -lo: estrutura cristalinaAprecia -se que um de seus 2P orbitais não tenha elétrons, que aceite um elétron do orbital menor de energia por promoção eletrônica; E assim, o Atom adquire a capacidade de formar até quatro ligações covalentes através de seus quatro orbitais híbridos SP3.
Observe que os quatro orbitais sp3 Eles são degenerados em energia (alinhados no mesmo nível). Os orbitais p Pure são mais enérgicos, e é por isso que eles estão acima dos outros orbitais híbridos (à direita da imagem).
Se houver três orbitais híbridos, é porque um orbital permanece p sem hibridação; Portanto, eles são três orbitais de SP2. E quando há dois desses orbitais híbridos, dois orbitais p Eles estão disponíveis para formar ligações duplas ou triplas, sendo a hibridação do f carbon.
Esses aspectos eletrônicos são essenciais para entender por que o carbono pode ser encontrado em muitos infinitos.
Números de oxidação
Antes de continuar com as estruturas, não são outras mencionar que, dada a configuração eletrônica do Valencia 2s22 p2, O carbono pode ter os seguintes números de oxidação: +4, +2, 0, -2 e -4.
Porque? Esses números correspondem à suposição de que existe uma ligação iônica de modo que você forme os íons com as respectivas cargas; isto é, c4+, C2+, C0 (neutro), c2- e C4-.
Para que o carbono tenha um número de oxidação positivo, ele deve perder elétrons; E para fazer isso, precisa necessariamente estar ligado a átomos muito eletronegativos (como oxigênio).
Enquanto isso, para que o carbono tenha um número de oxidação negativo, ele deve ganhar elétrons ligando a metal ou menos átomos eletronegativos do que ele (como hidrogênio).
A primeira questão de oxidação, +4, significa que o carbono perdeu todos os elétrons de valência; Os orbitais 2s e 2p estão vazios. Se o 2P orbital perder seus dois elétrons, o carbono terá +2 número de oxidação; Se você ganhar dois elétrons, terá -2; E se ele ganhar dois elétrons mais completando seu octeto de Valencia, -4.
Exemplos
Por exemplo, para CO2 O número de oxidação do carbono é +4 (porque o oxigênio é mais eletronegativo); enquanto para Cho4, é -4 (porque o hidrogênio é menos eletronegativo).
Pode atendê -lo: hidrazina: estrutura, propriedades, síntese, usosPara cap3Oh, o número de oxidação do carbono é -2 (+1 para H e -2 para O); Enquanto para hcooh, é +2 (verifique se a soma de 0).
Outros estados de oxidação, como -3 e +3, também são prováveis, especialmente quando se trata de moléculas orgânicas; Por exemplo, em grupos metil, -ch3.
Geometrias moleculares
Na imagem superior, não apenas a hibridação dos orbitais para o átomo de carbono, mas também as geometrias moleculares resultantes quando vários átomos (esferas pretas) estão ligadas a um centro. Este átomo central para descartar um ambiente geométrico específico no espaço deve possuir a respectiva hibridização química que é permitida.
Por exemplo, para o tetraedro, o carbono central tem hibridação SP3; Porque esse é o arranjo mais estável para os quatro sp híbridos3. No caso de carbonos SP2, Eles podem formar links duplos e descartar um ambiente plana trigonal; E assim, esses triângulos definem um hexágono perfeito. E para uma hibridação do SP, os carbonos adotam geometria linear.
Assim, as geometrias observadas nas estruturas de todos os outros são simplesmente governados em tetraedra (sp3), hexágonos ou pentágonos (sp2) e linhas (SP).
O tetraedro define uma estrutura 3D, enquanto hexágonos, pentágonos e linhas, estruturas 3D ou 2D; Estes últimos passam a ser os aviões ou lençóis semelhantes às paredes dos favos de mel de abelha:
 Parede com desenhos hexagonais de um favo de mel em abelhas em analogia com os aviões compostos por carbonos SP2. Fonte: Pixabay.
Parede com desenhos hexagonais de um favo de mel em abelhas em analogia com os aviões compostos por carbonos SP2. Fonte: Pixabay. E se dobrarmos esta parede hexagonal (pentagonal ou mista), obteremos um tubo (nanotubos) ou uma bola (fulerene) ou outra figura. As interações entre esses números dão origem a diferentes morfologias.
Sólidos amorfos ou cristalinos
Deixando geometrias, hibridizações ou morfologias das possíveis estruturas de carbono, seus sólidos podem classificar globalmente em dois tipos: amorfo ou cristalino. E entre essas duas classificações, seus dois são distribuídos.
O carbono amorfo é simplesmente aquele que apresenta uma mistura arbitrária de tetraedros, hexágonos ou linhas, incapaz de estabelecer um padrão estrutural; É o caso de carvão, vegetal ou carvão ativado, coca, fuligem, etc.
Enquanto o carbono cristalino consiste em padrões estruturais formados por qualquer uma das geometrias levantadas; Por exemplo, Diamond (rede tetraedra tridimensional) e grafite (lençóis hexagonais empilhados).
Pode atendê -lo: nitrato de sódio (nano3): estrutura, propriedades, usos, riscosOnde está o carbono?
Além de ser o elemento químico comum em todas as formas de vida, o carbono na natureza está presente em três formas cristalinas: diamante, grafite e guia.
Existem também várias formas minerais de carvão amorfas (antracite, linhita, burro, turfa), formas líquidas (variedades de petróleo) e refrigerante (gás natural).
Formulários
Novamente, como as propriedades e a estrutura, os usos ou aplicações são consistentes com os Alotrogos ou formas mineralógicas de carbono. No entanto, existem certas generalidades que podem ser mencionadas, além de alguns pontos altamente conhecidos. Tal são:
-O carbono tem sido usado há muito tempo como agente redutor mineral na obtenção de metais puros; Por exemplo, ferro, silício e fósforo, entre outros.
-É a pedra angular da vida, e a química e a bioquímica orgânica são os estudos desta reflexão.
-Também tem sido um combustível fóssil que permitiu que as primeiras máquinas fossem para suas engrenagens. Da mesma maneira, o gás de carbono para antigos sistemas de iluminação foi obtido dele. O carvão era sinônimo de luz, calor e energia.
-Misturado como um aditivo com ferro em diferentes proporções permitidas a invenção e melhoria dos aços.
-Sua cor preta ocorreu na arte, especialmente grafite e todos os escritos feitos com seus golpes.
Riscos e precauções
Carbono e seus sólidos não representam nenhum risco à saúde. Que se preocupou com uma bolsa de carvão? Eles os vendem para lotes dentro dos corredores de alguns mercados e, desde que não haja perto de fogo, seus blocos pretos não queimarão.
A Coca -Cola, por outro lado, pode representar um risco se seu teor de enxofre for alto. Quando a combustão liberará gases de enxofre que, além de serem tóxicos, contribuem para a chuva ácida. E embora o CO2 Em pequenas quantidades que não podem nos sufocar, causa um enorme impacto no meio ambiente como um gás de efeito estufa.
Nesta perspectiva, o carbono é um perigo "longo a termo", uma vez que sua combustão altera o clima do nosso planeta.
E em um sentido mais físico, sólidos ou materiais carbonáceos se forem pulverizados são facilmente transportados pelas correntes de ar; E, consequentemente, eles são apresentados diretamente nos pulmões, o que pode danificá -los irremediavelmente.
Do resto, é muito comum consumir "carvão" quando um pouco de comida está cozinhando.
Referências
- Morrison, r. T. e boyd, r, n. (1987). Quimica Organica. 5ª edição. Interamericano Editorial Addison-Wesley.
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. Aminas. (10ª edição.). Wiley Plus.

