Estrutura de carbonato de zinco (ZNCO3), propriedades, usos

- 4514
- 898
- Terrell Stokes
Ele Carbonato de zinco É um composto inorgânico formado pelos elementos de zinco (Zn), carbono (c) e oxigênio (O) (O). Sua fórmula química é ZnCo3. O zinco tem um estado de oxidação de +2, carbono +4 e oxigênio -2.
É um sólido incolor ou branco encontrado na natureza formando o Mineral Smithsonite, no qual pode estar sozinho ou com outros elementos como cobalto ou cobre, que dão uma coloração violeta ou verde, respectivamente, respectivamente.
 Smithsonita, Mineral ZnCo3. Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons.
Smithsonita, Mineral ZnCo3. Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons. O ZNCO3 É quase insolúvel em água, mas é facilmente dissolvido em ácidos diluídos, como o íon carbonato em forma carbonônica ácida (H2Co3), que então se torna o gás CO2 e água.
É usado como anti -séptico em feridas de animais e às vezes é fornecido na dieta para evitar doenças causadas por deficiência de zinco.
Serve para adiar os queimados que certas fibras, plásticos e gengivas quando eles entram em contato com o fogo. Permite separar minerais de arsênico tóxico de outras rochas com segurança.
Tem sido usado em pastas dentadas para recuperar a dentina nos dentes sob o clareamento.
[TOC]
Estrutura
O ZNCO3 É formado por um cátion Zn2+ e um ânion co32-. Carbono no íon carbonato tem um estado de oxidação de +4. Este íon tem uma estrutura plana com os três átomos de oxigênio ao redor do átomo de carbono.
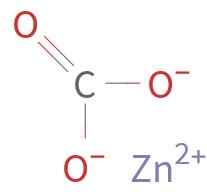 Estrutura química de carbonato de zinco. Autor desconhecido / domínio público. Fonte: Wikimedia Commons.
Estrutura química de carbonato de zinco. Autor desconhecido / domínio público. Fonte: Wikimedia Commons. Nomenclatura
- Carbonato de zinco
- Monocarbonato de zinco
- Sal de zinco com ácido carbônico
- Smithsonita
- Spat de zinco
Propriedades
Estado físico
Branco sólido ou cristalino incolor. Cristais rombic.
 Carbonato de zinco. Ondřej MANGL / PUB DOMAIN. Fonte: Wikimedia Commons.
Carbonato de zinco. Ondřej MANGL / PUB DOMAIN. Fonte: Wikimedia Commons. Peso molecular
125,4 g/mol
Ponto de fusão
A 140 ºC, ele se decompõe sem derreter.
Densidade
4.398 g/cm3 A 20 ° C.
Solubilidade
Praticamente insolúvel em água: 0,000091 g/100 g de h2Ou a 20 ° C. Solúvel em ácidos diluídos, álcalis e sais de amônio. Insolúvel em amônia, álcool e acetona.
Propriedades quimicas
Reage com ácidos formando dióxido de carbono:
ZNCO3 + 2 h+ → Zn2+ + H2Ou + co2↑
Ele se dissolve em bases que formam hidróxido, que é parcialmente dissolvido, formando um íon de zincato:
Pode atendê -lo: bromo: história, estrutura, configuração eletrônica, propriedades, usosZNCO3 + 2 Oh- → Zn (OH)2 + Co32-
Zn (OH)2 + H2Ou + oh- → [Zn (OH)3(H2QUALQUER)]-
Não é inflamável. Quando aquecido em sua decomposição produz óxido de zinco e dióxido de carbono, mas pode emitir monóxido de carbono (CO).
ZNCO3 + calor → ZnO + CO2↑
Obtenção
O Mineral Smithsonite é obtido, anteriormente chamado de Spat's Spat.
Também pode ser preparado misturando uma solução de carbonato de sódio com sal de zinco, como sulfato de zinco. O sulfato de sódio permanece dissolvido e o carbonato de zinco precipita:
ZNSO4 + N / D2Co3 → ZNCO3↓ + Na2SW4
Formulários
Em tratamentos médicos
Este composto permite que você obtenha alguns produtos farmacêuticos. É aplicado à pele inflamada na forma de poeira ou loção.
Em aplicações veterinárias
O ZNCO3 Serve como um protetor adstringente, anti -séptico e tópico de animais em animais.
Ele também permite evitar doenças causadas pela deficiência de zinco, por isso é usado como suplemento na dieta de alguns animais, desde que as quantidades administradas estejam dentro das normas estabelecidas pelas agências de saúde.
 O carbonato de zinco às vezes é administrado como um micronutriente para evitar doenças em porcos. Autor desconhecido / CC0. Fonte: Wikimedia Commons.
O carbonato de zinco às vezes é administrado como um micronutriente para evitar doenças em porcos. Autor desconhecido / CC0. Fonte: Wikimedia Commons. Nos surtos de porceratose em porcos, é adicionado à dieta destes. Esta doença é uma alteração da pele na qual a camada córnea não é adequadamente formada.
Como retardador de chama
É usado como enchimento à prova de fogo para borracha e plásticos expostos a altas temperaturas. Permite que você proteja as fibras têxteis do fogo.
No caso de têxteis de algodão, é aplicado ao tecido junto com alguns álcalis. Isso ataca diretamente os grupos hidroxila primário (-CH2Oh) de celulose e os torna sodiocelulose (-ch2COM UM).
A ruptura dos links de celulose pela alcalina favorece maior penetração das cadeias da estrutura celulósica compacta, de modo que mais quantidade do ZNCo3 consegue entrar na zona amorfa desta e sua dispersão é facilitada.
Pode atendê -lo: vanádio: história, propriedades, estrutura, usos Alguns tecidos de algodão podem conter ZnCo3 em suas fibras para torná -las resistentes ao fogo. Socken_farbig.JPEG: Scott Bauerivative Work: Sock / Public Domain. Fonte: Wikimedia Commons.
Alguns tecidos de algodão podem conter ZnCo3 em suas fibras para torná -las resistentes ao fogo. Socken_farbig.JPEG: Scott Bauerivative Work: Sock / Public Domain. Fonte: Wikimedia Commons. Como resultado disso, a quantidade de gás inflamável que pode ocorrer com fogo é reduzido.
Em tratamentos dentários
Certos cremes dentifricos baseados em nanocristais de carbonato de zinco e hidroxiapatita aplicados regularmente à prótese reduzem a hipersensibilidade com mais eficácia do que aqueles baseados no fluoreto.
Os nanocristais da ZNCo3 e a hidroxiapatita tem um tamanho, forma, composição química e cristalinidade semelhante à da dentina, para que os túbulos dentários possam ser fechados com a aplicação desses materiais.
 Nanopartículas de ZnCo3-Hidroxiapathite foram testados com sucesso para reduzir a sensibilidade em dentes branqueados. Autor: mix de fotos. Fonte: Pixabay.
Nanopartículas de ZnCo3-Hidroxiapathite foram testados com sucesso para reduzir a sensibilidade em dentes branqueados. Autor: mix de fotos. Fonte: Pixabay. Esse tipo de pasta dentária foi útil após os processos de clareamento dental.
Para separar minerais de arsênico perigosos
Métodos minerais de arsênico de rochas de enxofre (como galena, calcopirita e pirita) foram testados usando o ZNCO)3. O minério em arsênico deve ser separado de outros porque esse elemento é um poluente muito tóxico e venenoso para seres vivos.
Para conseguir isso, a mistura de rochas terrestres é tratada com uma solução de sulfato de zinco e carbonato de sódio a um pH de 7,5-9,0 e um composto xantato.
 Arsenopirita. Este mineral deve ser separado dos outros, porque contém tóxico de arsênico. A separação pode ser alcançada com carbonato de zinco. James St. John/CC por (https: // criativeCommons.Org/licenças/por/2.0). Fonte: Wikimedia Commons.
Arsenopirita. Este mineral deve ser separado dos outros, porque contém tóxico de arsênico. A separação pode ser alcançada com carbonato de zinco. James St. John/CC por (https: // criativeCommons.Org/licenças/por/2.0). Fonte: Wikimedia Commons. A eficácia da fórmula é atribuída à formação de pequenas partículas de ZNCO3 Na superfície da arsenopirita, tornando -a hidrofílica (relacionada à água), para que você não possa aderir às bolhas de ar e não pode flutuar, precipitar e se separar dos outros minerais.
Ao obter outros compostos de zinco
O carbonato de zinco tem sido usado para obter nanoestruturas hidrofóbicas de borato da Fórmula 3ZNO • 3b2QUALQUER3• 3,5h2QUALQUER. Este material pode ser usado como um aditivo retardador de chama em polímeros, madeira e têxteis.
Na recuperação de zinco de efluentes residuais
Águas sintéticas ricas em íons de zinco descartados por processos de eletrodeposição podem ser tratados por tecnologia de leito fluidizado usando carbonato de sódio para precipitar o ZNCO3.
Pode atendê -lo: álcool secundário: o que é, estrutura, propriedades, usosQuando o Zn precipita2+ Na forma de carbonato diminui sua concentração, o sólido obtido é filtrado e as águas podem ser descartadas com segurança. O ZNCO3 precipitado é alta pureza.
Outros aplicativos
Permite preparar outros compostos de zinco. É usado em cosméticos. Serve como pigmento e é usado na fabricação de porcelana, cerâmica e cerâmica.
Riscos
Inalação de poeira ZNCO3 Pode causar a decisão, tosse, peito, febre e desconforto de sudorese. Sua ingestão produz náusea e vômito.
Efeitos no meio ambiente
O principal risco é o seu efeito no meio ambiente, por isso deve ser evitado para ser espalhado neste. É muito tóxico para a vida aquática com consequências que duram nos organismos vivos.
Referências
- OU.S. Biblioteca Nacional de Medicina. (2019). Carbonato de zinco. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Chumbo, d.R. (Editor) (2003). Manual de Química e Física do CRC. 85º CRC Press.
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- Sharma, v. et al. (2018). Síntese de nanoneedles de carbonato de zinco, para potencial retardador de chama para têxteis de algodão. Cellulose 25, 6191-6205 (2018). Link recuperado.Springer.com.
- Guan, e. et al. (2020). ZnCo3 coloidal como um depressor poderoso de arsenopirita em polpa fracamente alcalina e o mecanismo de interação. Minerais 2020, 10, 315. MDPI se recuperou.com.
- Doenças da pele, olho, conjuntiva e orelha externa. (2017). Em medicina veterinária (décima primeira edição). Recuperado de cientedirect.com.
- Hannig, m. e hannig, c. (2013). Nanobiomateriais em odontologia preventiva. Em nanobiomateriais em odontologia clínica. Capítulo 8. Recuperado de cientedirect.com.
- Tugrul, n. et al. (2015). Síntese de nanoestruturas hidrofóbicas Borato de zinco de carbonato de zinco e caracterização do produto. Res Chem Intermediate (2015) 41: 4395-4403. Link recuperado.Springer.com.
- Luna, m.D.G., et al. (2020). Recuperação de grânulos de zinco de águas residuais de eletroplatação sintética usando processo de cristalização homogênea de kames fluidizados. Int. J. Ambiente. Sci. Technol. 17, 129-142 (2020). Link recuperado.Springer.com.
- « Características de proposições particulares e universais
- Qual é o processo econômico? Estágios e exemplos »

