Estrutura de potássio (K2CO3), propriedades, usos, obtenção

- 4250
- 119
- Conrad Schmidt
Ele Carbonato de potássio É um composto inorgânico formado por dois íons de potássio k+ e um co de carvão Co32-. Sua fórmula química é k2Co3. É um sólido branco higroscópico, ou seja, absorve facilmente a água do meio ambiente. Portanto, em laboratórios, é usado para absorver água de outras substâncias.
É muito solúvel em soluções alcalinas que formam água, que são ricas em íons OH-e, portanto, com um alto valor de pH. Suas soluções aquosas, porque são alcalinas, são usadas em vários processos industriais para absorver gases ácidos, como dióxido de carbono2 e sulfeto de hidrogênio H2S, então facilmente neutraliza -os.
 Carbonato de potássio k2Co3 sólido. Ondřej Mangl [Domínio Público]. Fonte: Wikimedia Commons.
Carbonato de potássio k2Co3 sólido. Ondřej Mangl [Domínio Público]. Fonte: Wikimedia Commons. O K2Co3 É usado para preparar sabonetes, produtos de limpeza, detergentes para lavar roupas e misturas para lavar a louça. Também é usado no processamento de algumas fibras têxteis, como lã.
É amplamente utilizado em laboratórios de química, por exemplo, para absorver água de outros compostos ou para alcalizar misturas de reações químicas e também em análise química.
Também é adicionado a alguns alimentos, por exemplo, para eliminar o sabor amargo das sementes de cacau durante a produção de chocolate.
[TOC]
Estrutura
O carbonato de potássio é composto de dois cátions de potássio K+ e um ânion carbonato Co32-. O ânion carbonato tem uma estrutura plana e simétrica, enquanto os três átomos de oxigênio envolvem o carbono formando um triângulo plano.
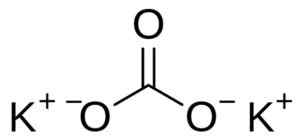 Estrutura de carbonato de potássio k2Co3. Usuário: Edgar181 [Domínio Público]. Fonte: Wikimedia Commons.
Estrutura de carbonato de potássio k2Co3. Usuário: Edgar181 [Domínio Público]. Fonte: Wikimedia Commons. Nomenclatura
- Carbonato de potássio
- Carbonato de potássio
- Carbonato de Dipotasium
- Potassa
- Sal de potássio de ácido carbônico.
Propriedades
Estado físico
Sólido cristalino Solid Color to White.
Peso molecular
138.205 g/mol.
Ponto de fusão
899 ºC.
Ponto de ebulição
Se decompõe.
Densidade
2,29 g/cm3
Solubilidade
Muito solúvel em água: 111 g/100 g de água a 25 ° C. Insolúvel em etanol e acetona.
Pode atendê -lo: contribuições da química para a medicinaph
Uma solução aquosa pode ter um pH de 11,6, ou seja, é bastante alcalino.
Propriedades quimicas
O carbonato de potássio é delicado ou higroscópico, ou seja, absorve a umidade do ambiente. Tem um hidrato estável, o k2Co3.2h2QUALQUER.
O K2Co3 Em solução aquosa, é hidrolisado, ou seja, reage com a água liberando grupos de OH- Quais são os que dão alcalinidade às soluções:
Co32- + H2Ou ⇔ Oh- + HCO3-
HCO3- + H2Ou ⇔ Oh- + H2Co3
Obtenção
Pode ser obtido das cinzas restantes ao queimar plantas. Também pela carbonatação de hidróxido de potássio koh, ou seja, adicionando excesso de dióxido de carbono Co2 Para Koh:
KOH + CO2 → KHCO3
2 KHCO3 + calor → k2Co3 + H2QUALQUER
Outra maneira de obtê -lo é aquecer o cloreto de potássio KCL com carbonato de magnésio3, água e co2 sob pressão. Um magnésio hidratado duplo e sal de potássio e potássio é obtido primeiro3.KHCO3.4h2Ou chamado Engels Salt:
2 kcl + 3 mgCo3 + Co2 + 5 h2O → MGCO3.KHCO3.4h2Ou ↓ + mgcl2
O sal hidratado duplo de Engels precipita e se separa da solução por filtração. Então o carbonato de carro de potássio é aquecido e formado2Co3 que adicionando água se dissolve enquanto o carbonato de magnésio MGCO3 permanece insolúvel e eliminado por filtração.
MGCO3.KHCO3.4h2O + calor → MGCO3↓ + 2 k+ + Co32- + Co2↑ + 9 h2QUALQUER
Formulários
Na absorção de CO2 Em processos industriais
A solução de carbonato de potássio é o tratamento clássico para remoção de dióxido de carbono Co2 Em vários processos, especialmente em altas pressões e aplicações de temperaturas.
 K Soluções2Co3 Eles são usados para absorver co2 Em vários processos industriais. Autor: Nicola Giordano. Fonte: Pixabay.
K Soluções2Co3 Eles são usados para absorver co2 Em vários processos industriais. Autor: Nicola Giordano. Fonte: Pixabay. A remoção de CO2 ocorre de acordo com a seguinte reação:
K2Co3 + Co2 + H2Ou ⇔ 2 KHCO3
Este método é usado, por exemplo, para tratar o gás natural. Também em plantas de geração de energia, para evitar a emissão de CO2 para a atmosfera e na produção de gelo seco.
Pode atendê -lo: hidróxido de cobre (ii): estrutura, propriedades, nomenclatura, usos K Soluções2Co3 Eles são usados para obter co2 que serve para fazer gelo seco. ProjectmanHattan [CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons.
K Soluções2Co3 Eles são usados para obter co2 que serve para fazer gelo seco. ProjectmanHattan [CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons. K -Solução2Co3 Pode ser regenerado termicamente, ou seja, devido a temperaturas que aquecem cerca de 100 ° C.
Para que a solução de carbonato de potássio absorva o CO2 em boa velocidade, são adicionados promotores que aceleram o processo como a dietanolamina (DEA).
Na remoção de H2S de certos processos
As soluções de carbonato de potássio também são usadas para remover o gás sulfeto de hidrogênio H2S de correntes de processo. Às vezes, o tifosfato de potássio K é adicionado3Po4 Para tornar mais rápido o processo.
Em Laboratórios de Química
O K2Co3 permite a síntese orgânica, por exemplo, em reações de condensação e neutralizar. Serve para remover a água dos fluidos orgânicos, como um agente desidratante ou dessecante no laboratório.
Também é usado em reações químicas analíticas e em alcalinidade na indústria farmacêutica.
Na indústria de produtos de limpeza
O K2Co3 É usado para fabricar sabão, fórmulas de limpeza, produtos para roupas e lavagem de pratos e também para preparar shampoo e outros produtos de cuidados pessoais.
 O K2Co3 É usado na preparação de sabão. Lacrosus [domínio público]. Fonte: Wikimedia Commons.
O K2Co3 É usado na preparação de sabão. Lacrosus [domínio público]. Fonte: Wikimedia Commons. Na indústria de alimentos
Carbonato de potássio é adicionado a vários alimentos com vários propósitos.
Por exemplo, é adicionado às sementes de cacau para eliminar seu sabor amargo e usá -las na produção de chocolate. É adicionado às uvas no processo de secagem para obter uvas Raisid.
 As sementes de cacau são tratadas com k2Co3 Para reduzir seu gosto amargo ao fazer chocolate. Autor: Magali Couret. Fonte: Pixabay.
As sementes de cacau são tratadas com k2Co3 Para reduzir seu gosto amargo ao fazer chocolate. Autor: Magali Couret. Fonte: Pixabay. Na loja de pastelaria, é usado como um leudant (agindo como um fermento) da farinha para preparar alimentos assados.
Pode atendê -lo: Luteco: estrutura, propriedades, usos, obtenção O K2Co3 Pode ser usado como LEDANT em bolos, porque quando emite co2 Durante o cozimento, esses aumentam o volume. Autor: Pixel1. Fonte: Pixabay.com
O K2Co3 Pode ser usado como LEDANT em bolos, porque quando emite co2 Durante o cozimento, esses aumentam o volume. Autor: Pixel1. Fonte: Pixabay.com Em fertilizantes
O K2Co3 É usado para fertilizar solos ácidos, como o Coal Ion Co32- Em contato com a água produz íons OH- que aumentam o pH do solo. Além do potássio k+ É um nutriente para plantas.
O carbonato de potássio também tem sido usado para fazer fertilizantes de liberação lenta.
Um fertilizante de liberação lenta libera ou nutrientes soltos para que não sejam dissolvidos e arrastados pela água. Graças a isso, eles podem gastar mais tempo disponível para as raízes da planta.
Em várias aplicações
Carbonato de potássio k2Co3 Também é usado para:
- Secagem, limpeza de lã limpa e outras atividades da indústria têxtil
- Obtenção de outros sais de potássio orgânico e inorgânico, como o cianeto de potássio KCN.
- Função como um regulador de acidez em vários processos.
- Fazer cerâmica e cerâmica.
- Processos de gravura e litografia.
- bronzeado.
- Prepare tintas impressas, pigmentos.
- Vidro de fabricação2Co3 É mais compatível que o de carbonato de sódio na2Co3 Com óxidos de chumbo, bário e estrôncio que esses vidro contêm.
- Tratamento de água.
- Atrasar o incêndio (na forma de soluções aquosas).
- Inibir a corrosão e como um agente anti-consultório em equipes de processo.
Referências
- OU.S. Biblioteca Nacional de Medicina. (2019). Carbonato de potássio. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Steele, d. (1966). A química dos elementos metálicos. Pergamon Press Ltd. Londres.
- Mokhatab, s. et al. (2019). Tratamento de gás natural. A solução de carbonato de potássio. No Manual de Transmissão e Processamento de Gás Natural (quarta edição). Recuperado de cientedirect.com.
- Kakaras, e. et al. (2012). Combustão de leito fluidizado pressurizado (PFBC) Sistemas de ciclo combinados. Combustão de leito fluidizado pressurizado com captura e armazenamento de carbono. Em sistemas de ciclo combinados para geração de energia de emissão de quase zero. Recuperado de cientedirect.com.
- Speight, j.G. (2019). Produção de hidrogênio. Moldura molhada. Na recuperação de óleo pesado e atualização. Recuperado de cientedirect.com.
- Branan, c.R. (2005). Tratamento de gás: Capítulo Atualizado por Chris Higman. Processo de carbonato quente. Em Regras Pingo. Recuperado de cientedirect.com.
- Kirk-Othmer (1994). Enciclopédia de tecnologia química. Quarta edição. John Wiley & Sons.
- Enciclopédia de química industrial de Ullmann. (1990). QUINTA EDIÇÃO. Vch verlagsgellschaft mbh.
- Li, e. e Cheng, f. (2016). Síntese de um novo fertilizante de potássio de liberação lenta de escória modificada por magnésio por carbonato de potássio. J Air Waste Manag Assoc, 2016 agosto; 66 (8): 758-67. NCBI se recuperou.Nlm.NIH.Gov.

