Estrutura de carbonato de cálcio, propriedades, formação, usos

- 1110
- 98
- Terrence King IV
Ele carbonato de cálcio É um composto inorgânico cuja fórmula química é caco3. É encontrado principalmente em minerais como calcita e aragonite. Da mesma forma, o calcário compõe, uma rocha sedimentar na qual o mineral da calcita está presente.
Este importante carbonato de metal é obtido industrialmente por extração e trituração dos minerais que o contêm; Para esse fim, o mármore é usado principalmente. Outro processo está no uso de óxido de cálcio, que se torna hidróxido de cálcio, precipitando carbonato de cálcio pela adição de dióxido de carbono. Dessa maneira, os cristais são obtidos de uma ampla gama de tamanhos.
 A concha do caracol é composta principalmente de carbonato de cálcio. Fonte: Pixabay.
A concha do caracol é composta principalmente de carbonato de cálcio. Fonte: Pixabay. Eles também podem ser usados para a produção industrial de caco3, Em pequena escala, as conchas das amêijoas, as conchas de ovo e as conchas de ostras nas quais está presente.
O carbonato de cálcio presente no calcário é dissolvido por dióxido de carbono na água, gerando bicarbonato de cálcio. Essa ação pode causar as cavernas e é uma causa da alcalinização da água; evento de grande importância na manutenção da vida nele.
Foi usado na construção e elaboração de esculturas; Exemplos disso são o parceiro de Atenas, a Catedral de Cracóvia e a escultura de Abraham Lincoln em Washington. No entanto, sua suscetibilidade à chuva ácida diminuiu seu uso na construção.
O carbonato de cálcio teve várias aplicações na indústria como um material de preenchimento de plástico e papel. Na medicina, tem sido usado para controlar a acidez gástrica; como suplemento de cálcio dietético; controlar a fosfatia em pacientes com insuficiência renal crônica, etc.
[TOC]
Estrutura
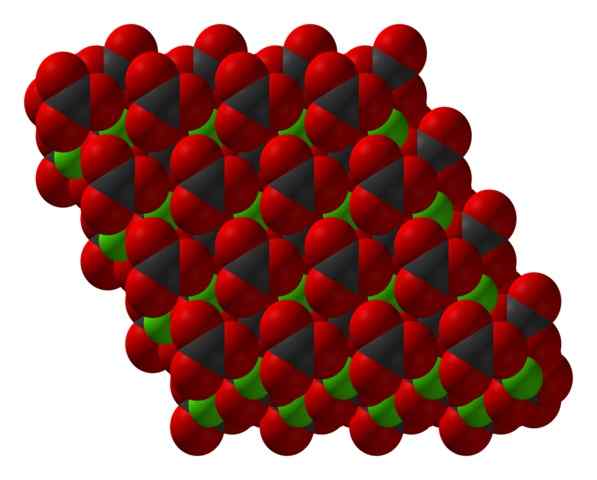 Estrutura cristalina Chanco3 representada com um modelo de preenchimento de espaço. Fonte: CCOIL [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]
Estrutura cristalina Chanco3 representada com um modelo de preenchimento de espaço. Fonte: CCOIL [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] A fórmula de carbonato de cálcio, caco3, indica que a proporção entre os íons Ca2+ e companhia32- É 1: 1; isto é, para cada CA2+ Há um CO32- de contraparte interagindo eletrosticicamente com ele. Assim, a ligação iônica acaba tendo esses íons para formar padrões estruturais que definem um cristal.
Na imagem superior, a estrutura do caco é mostrada3. Esferas verdes correspondem aos cátions2+, e as esferas vermelhas e pretas para os co -anões32-. Observe que a estrutura parece ser formada por várias camadas: uma de cálcio e outra de carbonato; o que significa que cristaliza em uma estrutura hexagonal compacta.
Pode servir você: cloreto de amônio (NH4Cl)Esta fase hexagonal (β-caco3) Corresponde a um polimorfo. Existem outros dois: ortorrombic (λ-caco3) e um hexagonal ainda mais denso (μ-caco3). A imagem inferior ajuda a visualizar melhor o feliz hexágono:
 Estrutura hexagonal de calcita. Materialscientist na Wikipedia inglesa [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]
Estrutura hexagonal de calcita. Materialscientist na Wikipedia inglesa [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] No entanto, dependendo da temperatura (e para este sal, a pressão), os íons em suas vibrações são reajustados a outras estruturas; Estes são os polimorfos acima mencionados (β, λ e μ).
Como eles parecem não são bem conhecidos, a menos que sejam mencionados com seus nomes mineralógicos em uma próxima seção.
Dureza da proteína
Cristais de Caco3 Eles não estão sozinhos: eles podem hospedar impurezas como outros cátions de metal que os tingem em cores; o proteínas, incorporando uma matriz orgânica que de alguma forma contribui para sua dureza natural.
As proteínas diminuem a tensão experimentada pelos cristais um pelo outro antes de uma pressão ou impacto. Como? Ao intercalar entre os cristais, agindo como se fosse um "bloco" (semelhante ao de tijolos-cimento).
É por isso que esse composto ou mineral é biocompatível, e não se surpreende que faça parte das unhas, conchas marinhas, conchas ou ossos dos ouriços. Foi uma fonte de inspiração para aqueles que se dedicam ao desenvolvimento de novos materiais.
Propriedades
Outros nomes
-Aragonite
-Calcito
-Volterite
-Leite de cálcio
-Quadro branco
-Mármore
Massa molar
100.086 g/mol.
Descrição física
Banheiro de poeira branca.
Sabor
Semelhante ao giz, sem gosto.
Pontos de fusão e de ebulição
Ele quebra porque libera co2 Antes mesmo de derreter ou ferver.
Solubilidade
Praticamente insolúvel em água e álcool. É dissolvido com efervescência em ácidos acéticos e clorídrico diluídos. Hidróxidos, no entanto, eles reduzem sua solubilidade. Enquanto isso, sais de amônio e dióxido de carbono aumentam a solubilidade do carbonato de cálcio na água.
Densidade
2,7 a 2,95 g/cm3.
Decomposição
Cerca de 825 ºC é dividido em óxido de cálcio (cal) e dióxido de carbono (CO2).
ph
8 a 9
Índice de refração
-1.7216 a 300 nm e 1.6584 a 589 nm (calcita).
-1.5145 a 300 nm e 1.4864 a 589 nm (Aragonite).
Incompatibilidades
Com ácidos, sais de alumínio e amônio.
Entalpia de fusão
36 kJ/mol a 800 ºC (calcita).
Pode atendê -lo: molaridade: concentração, unidades, cálculo, exercíciosProduto de solubilidade constante
3.36 · 10-9 a 25 ºC.
Dureza
-3.0 (calcita)
-3.5 - 4.0 (Aragonite) na escala MOHS.
Transições de fase
O Aragonite é metaestável e irreversivelmente muda para calcita quando aquece em ar seco para 400 ºC.
Reatividade
O carbonato de cálcio reage com os ácidos, liberando dióxido de carbono, cálcio iônico e água.
O carbonato de cálcio é combinado com água saturada com dióxido de carbono, equivalente ao ácido carbônico (H2Co3), Para formar bicarbonato de cálcio.
Treinamento
O giz, o mármore e o calcário, os dois primeiros minerais e um material rochoso, o terceiro, contêm carbonato de cálcio e são de origem sedimentar, eles são considerados formados pela sedimentação de caracóis por milhões de anos de anos.
O pH pode ser o fator mais importante na formação de polimorfos a uma temperatura de 24 ° C. O Vaterita é o principal produto em uma faixa de pH entre 8,5 e 10; Aragonite é pH 11; e a calcita a pH> 12.
Sabe -se também que muitas algas de água doce constroem cristais de calcita quando crescem em um ambiente saturado de cálcio. Além disso, as microalgas são capazes de causar precipitação de carbonato de cálcio.
Formas de carbonato de cálcio
Nas imagens abaixo, as três formas ou polimorfos principais serão mostrados para carbonato de cálcio:
 Cristal de Calcita. Fonte: Parent Géry [Domínio Público]
Cristal de Calcita. Fonte: Parent Géry [Domínio Público] Cristal de aragonita. Fonte: Battistini Riccardo [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]
Cristal de aragonita. Fonte: Battistini Riccardo [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] Cristais de Vaterita. Fonte: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]
Cristais de Vaterita. Fonte: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]
De cima para baixo estão os polimorfos de calcita, aragonite e Vaterita. Observe a diferença entre a morfologia de seus cristais (a cor é típica de suas origens e características de seus ambientes).
A Vaterita é mais opaca que a calcita, este último se tornando completo. Enquanto isso, os cristais de aragonita se assemelham a pequenos monólitos alongados.
Se amostras desses três polimorfos forem observadas sob o microscópio eletrônico, seus cristais (de tons acinzentados porque a técnica não permite resolução de cores), as mesmas morfologias seriam encontradas como em escalas macroscópicas; isto é, à primeira vista.
Entre esses três polimorfos, a calcita é a mais abundante e estável, seguida pelo aragonita e, finalmente, a Vaterita, a mais rara das formas do caco3
Pode atendê -lo: calorimetria: quais estudos e aplicaçõesFormulários
Industriais
O carbonato de cálcio aumenta a resistência à torção e tração da borracha sintética e natural, mantendo sua flexibilidade. É usado na indústria da construção como ingrediente de cimento e como matéria -prima para limão. Seu uso foi diminuído porque é danificado pela chuva ácida.
O carbonato de cálcio é usado na purificação de ferro. Na forma de cal elimina o dióxido de enxofre presente no metal. A purificação de açúcar de beterraba é usada. Foi usado como um giz para ardósia, mas foi substituído pelo gesso para este aplicativo.
O carbonato de cálcio é misturado com a massa usada na colocação de vidro. O solo é usado como material de enchimento no filme microporoso usado em fraldas. Também é usado como material de enchimento em plásticos, como o PVC. Além disso, a força do plástico aumenta.
O carbonato de cálcio é usado para aumentar a capacidade de cobertura das pinturas. É usado como material de enchimento de papel porque é mais barato que a fibra de madeira, sendo capaz de representar mais de 10% do artigo.
Médicos
É usado como um antiácido para combater a hiperacidez gástrica e aliviar a indigestão. É usado como um suplemento de cálcio na dieta e no tratamento e prevenção da osteoporose. É usado no tratamento da hiperfosfatia em pacientes com insuficiência renal crônica.
Foi usado para reduzir os efeitos indesejáveis dos inibidores de protease usados no tratamento do HIV, observando em pacientes uma redução na diarréia.
Produz uma diminuição da pressão arterial em mulheres grávidas com hipertensão e pré -eclâmpsia, pois ambas podem estar associadas a um aumento na demanda de cálcio devido à presença fetal.
Outros
O carbonato de cálcio é usado na agricultura como fertilizante e para combater a acidez do solo. É usado como conservante, retentor de cores e reafirmando alimentos.
Além disso, é um ingrediente de pasta de dente e serve como abrasivo em poeira na limpeza e lavagem.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2019). Cálcio carbonato. Recuperado de: em.Wikipedia.org
- Centro Nacional de Informações sobre Biotecnologia. (2019). Cálcio carbonato. Banco de dados PubChem., CID = 10112. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Kai-Yin Chong, Chin-Hua Chia e Sarani Zakaria. (2014). Polymorphs Carbonato de cálcio na reação de temperatura. Proceedings da conferência da AIP 1614, 52; doi.org/10.1063/1.4895169
- Greg Watry. (1 de novembro de 2016). Descobrindo os cristais de carbonato de Howum obtêm força. Vantagem de marketing comercial. Recuperado de: rdmag.com
- Elementos americanos. (2019). Cálcio carbonato. Recuperado de: Americanments.com
- Elsevier. (2019). Cálcio carbonato. Cientedirect. Recuperado de: ScientEdirect.com
- Livro químico. (2017). Cálcio carbonato. Recuperado de: ChemicalBook.com
- « Localização do rio Pánuco, nascimento e boca, características
- Histórias e características tlazoltéotl »

