Carbonato de amônio ((NH4) 2CO3)
- 1884
- 143
- Orlando MacGyver
O que é carbonato de amônio?
Ele Carbonato de amônio É um sal de nitrogênio inorgânico, especificamente amoniacal, cuja fórmula química é (NH4)2Co3. É elaborado por métodos de síntese, entre os quais vale a pena usar a sublimação de uma mistura de sulfato de amônio e carbonato de cálcio: (NH4)2SW4(s)+ caco3(s) => (NH4)2Co3(s)+ caso4(S).
Geralmente, sais de amônio e carbonato de cálcio são aquecidos em um recipiente para causar carbonato de amônio. O método industrial que produz toneladas desse sal é passar dióxido de carbono através de uma coluna de absorção que contém uma solução de amônio na água e depois realizando uma destilação.
Os vapores que contêm amônio, dióxido de carbono e água são condensados para formar cristais de carbonato de amônio: 2NH3(g)+ h2Ou (L) + CO2(g) → (NH4)2Co3(S). Na reação, ocorre o ácido carbônico, H2Co3, Depois de dissolver o dióxido de carbono na água, e é esse ácido que produz seus dois prótons, h+, para duas moléculas de amônia.
Propriedades de carbonato de amônio
 Aparência de carbonato de amônio
Aparência de carbonato de amônio É um sólido branco, cristalino e incolor, com cheiros fortes e sabores de amônia. Derrete a 58 °.
No entanto, essa decomposição ocorre em duas etapas: primeiro uma molécula NH é liberada3, Produzindo bicarbonato de amônio (NH4HCO3); E segundo, se o aquecimento continuar, o carbonato é desproporção.
É um sólido solúvel em água e menos solúvel em álcoois. Formar pontes de hidrogênio com água e, quando 5 gramas se dissolvem em 100 gramas de água, gera uma solução básica com um pH em torno de 8,6.
Pode atendê -lo: Emulsificante: Processo de Emulsão, Aspectos Moleculares, AplicaçõesSua alta afinidade pela água é feita por um sólido higroscópico (absorve a umidade), e é por isso que é difícil encontrá -lo em sua forma de anidrídeo. De fato, sua forma monohidratada (NH4)2Co3· H2O), é o mais comum de todos e explica como o sal é um transportador de gás de amônia, causando cheiro.
No ar, ele se decompõe para gerar bicarbonato de amônio e carbonato de amônio (NH4NH2Co2).
Estrutura química
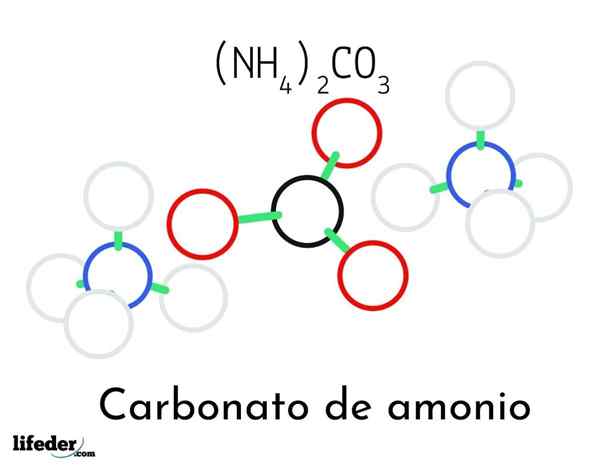
 Modelo de estrutura de carbonato de amônio; Dois cátions de amônio e um carbonato
Modelo de estrutura de carbonato de amônio; Dois cátions de amônio e um carbonato Na imagem superior, a estrutura química do carbonato de amônio é ilustrada. No meio está o Anion Co32-, o triângulo plano com o centro preto e as esferas vermelhas; E para seus dois lados, os cátions Amonios NH4+ com geometrias tetraédricas.
A geometria de íons de amônio é explicada pela hibridação SP3 do átomo de nitrogênio, ordenando os átomos de hidrogênio (as esferas brancas) ao redor na forma de um tetraedro. Entre os três íons são estabelecidos por pontes de hidrogênio (H3N-h- o-co22-).
Graças à sua geometria, um único co -anion32- pode formar até três pontes de hidrogênio; enquanto cátions NH4+ Talvez eles não possam formar suas quatro pontes de hidrogênio correspondentes por causa das repulsões eletrostáticas entre suas cargas positivas.
O resultado de todas essas interações é a cristalização de um sistema ortorrômbico. Por que é tão higroscópico e solúvel em água? A resposta está no mesmo parágrafo anterior: pontes de hidrogênio.
Essas interações são responsáveis pela rápida absorção de água do sal anidrídeo para formar (NH4)2Co3· H2QUALQUER). Isso resulta em mudanças no arranjo espacial dos íons e, portanto, na estrutura cristalina.
Pode atendê -lo: cloreto de níquel (nicl2): estrutura, propriedades, obtenção, usosCuriosidades estruturais
Não importa o quão simples seja o (NH4)2Co3, É tão sensível a inúmeras transformações que sua estrutura é um mistério submetido à verdadeira composição do sólido. Essa estrutura também varia de acordo com as pressões que afetam os cristais.
Alguns autores descobriram que os íons são ordenados como coplanares revestidos por pontes de hidrogênio (ou seja, uma corrente com uma sequência NH4+-Co32--…) Em que as moléculas de água provavelmente servem como conectores para outras correntes.
Ainda mais, transcendendo o céu terrestre, como esses cristais estão em condições espaciais ou interestelares? Quais são as suas composições em termos de estabilidade de espécies carbonatadas? Existem estudos que confirmam a grande estabilidade desses cristais presos em massas de gelo planetárias e cometas.
Isso lhes permite servir como reservas de carbono, nitrogênio e hidrogênio, que, recebendo radiação solar, podem ser transformadas em material orgânico, como aminoácidos.
Ou seja, esses blocos amoníacos de sorvete podem ser transportadores de "a roda que inicia a maquinaria da vida" no cosmos. Por esses motivos, seu interesse no campo da astrobiologia e bioquímica está aumentando.
Usa/aplicações
É usado como leu, pois ser aquecido produz dióxido de carbono e gases de amônio. O carbonato de amônio é, se você quiser, um precursor do fermento moderno e pode ser usado para assar biscoitos e biscoitos planos.
No entanto, seu uso para assar bolos não é recomendado. Devido à espessura dos bolos, os gases de amônio são retidos dentro e produzem um sabor desagradável.
Pode atendê -lo: ciclohexeno: estrutura, propriedades, síntese e usosÉ usado como expectorante, isto é, alivia a tosse ao descongestionar os brônquios. Possui ação de fungicida, usando por esse motivo na agricultura. É também um regulador da acidez presente em alimentos e é usado na síntese de uréia orgânica em altas pressões e hidantotas.
Riscos
O carbonato de amônio é altamente tóxico. Produz em humanos uma irritação aguda da cavidade oral ao colocar contato.
Além disso, se ingerido, causar irritação gástrica. Uma ação semelhante é observada nos olhos expostos ao carbonato de amônio.
A inalação de gases de decomposição de sal pode irritar o nariz, a garganta e os pulmões, causando tosse e sofrimento respiratório.
Exposição aguda para cães em amérmica ammonato na dose de 40 mg/kg de peso, causa vômito e diarréia. As doses mais altas de carbonato de amônio (200 mg/kg de peso) são geralmente letais. Os danos cardíacos são indicados como a causa da morte.
Se for aquecido a temperaturas muito altas e em um ar enriquecido com oxigênio, transmite gases tóxicos2.
Referências
- PubChem. (2018). Carbonato de amônio. Recuperado em 25 de março de 2018, do PubChem: PubChem.NCBI.Nlm.NIH.Gov
- Portal de química orgânica. ((2009-2018)). Reação de Bucherer-Bergs. Recuperado em 25 de março de 2018, do Organic Chemistry Portal: www.Química orgânica.org
- Wikipedia. (2018). Carbonato de amônio. Recuperado em 25 de março de 2018, da Wikipedia: em.Wikipedia.org
- A empresa química. (2018). A empresa química. Recuperado em 25 de março de 2018, da Chemical Company: Thechemco.com