Fórmulas e unidades de calor, características, como é medido, exemplos

- 4896
- 360
- Melvin Mueller
Ele aquecer Na física, é definido como o Energia térmica transferida desde que objetos ou substâncias que estejam em temperatura diferente sejam colocados em contato. Esta transferência de energia e todos os processos ligados a ele é o objeto de estudo da termodinâmica, um importante ramo da física.
O calor é uma das múltiplas formas que adota energia e um dos mais familiares. É por isso que vale a pena perguntar de onde vem. A resposta está nos átomos e moléculas que compõem o assunto. Essas partículas dentro das coisas não são estáticas. Podemos imaginá -los como pequenas contas unidas por molas macias, capazes de encolher e esticar facilmente.
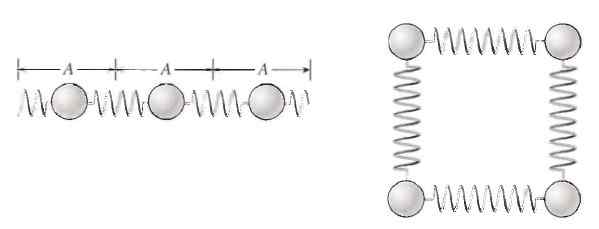 Átomos e moléculas vibram as substâncias internas, o que se traduz em energia interna. Fonte: p. Tiptens. Física: conceitos e aplicações.
Átomos e moléculas vibram as substâncias internas, o que se traduz em energia interna. Fonte: p. Tiptens. Física: conceitos e aplicações. Dessa maneira, as partículas são capazes de vibrar e sua energia pode ser facilmente transferida para outras partículas, e também de um corpo para outro.
A quantidade de calor que um corpo absorve ou produz depende da natureza da substância, sua massa e a diferença de temperatura. É calculado assim:
Q = m.Ce .Δt
Onde Q É a quantidade de calor transferido, m É a massa do objeto, Ce É o calor específico da substância e Δt = tfinal - Tinicial, isto é, a diferença de temperatura.
Como todas as formas de energia, o calor é medido em Joules, No sistema internacional (SI). Outras unidades apropriadas são: ergios No sistema CGS, Btu No sistema britânico e o caloria, um termo de uso comum para conhecer o conteúdo energético dos alimentos.
[TOC]
Características de calor
 O calor do fogo é energia na transferência. Fonte: Pixabay
O calor do fogo é energia na transferência. Fonte: Pixabay Existem vários conceitos -chave que devem ser levados em consideração:
-O calor está aproximadamente Energia em trânsito. Objetos não têm calor, eles apenas o dão ou absorvem de acordo com a circunstância. O que os objetos fazem são energia interna, Sob sua configuração interna.
Essa energia interna, por sua vez, é composta por energia cinética associada ao movimento vibratório e energia potencial, típica da configuração molecular. De acordo com essa configuração, uma substância transferirá o calor mais ou mais facilmente e isso se reflete em seu calor específico Ce, O valor mencionado na equação para calcular q.
-O segundo conceito importante é que o calor é sempre transferido do corpo mais quente para o mais frio. A experiência indica que o calor do café quente sempre passa em direção à porcelana da xícara e do prato, ou para o metal da colher com o qual é agitado.
-A quantidade de calor atribuída ou absorvida depende da massa do corpo em questão. Adicione a mesma quantidade de calorias ou joules a uma amostra com a massa x não aquece com outra cuja massa é 2x.
Pode servir a você: Ondas eletromagnéticas: Teoria Maxwell, Tipos, CaracterísticasA razão? Existem mais partículas na maior amostra, e cada uma estaria recebendo em média apenas metade da energia do que a menor amostra.
Equilíbrio térmico e conservação de energia
A experiência nos diz que, quando colocamos dois objetos em temperatura diferente, a temperatura de ambos será a mesma hora. Então pode -se afirmar que objetos ou sistemas, como eles também podem ser chamados, estão em Equilíbrio térmico.
Por outro lado, refletindo sobre como aumentar a energia interna de um sistema isolado, conclui -se que existem dois mecanismos possíveis:
i) aqueça, isto é, transfira energia de outro sistema.
i) Faça algum tipo de trabalho mecânico com ele.
Levando em consideração que a energia é preservada:
Qualquer aumento na energia interna do sistema é igual à quantidade de calor adicionada mais o trabalho que é feito nele.
Dentro da estrutura da termodinâmica, esse princípio de conservação é conhecido Primeira Lei da Termodinâmica. Dizemos que o sistema deve ser isolado, caso contrário, outras saídas de entrada ou energia devem ser consideradas no equilíbrio.
Como o calor é medido?
O calor é medido de acordo com o efeito que produz. Portanto, é a sensação de toque que informa rapidamente como quente ou frio é uma bebida, uma refeição ou qualquer objeto. Como dar ou absorver calor se traduz em mudanças de temperatura, medir essa tem uma idéia de quanto calor foi transferido.
O instrumento usado para medir a temperatura é o termômetro, um dispositivo fornecido com uma escala graduada para realizar a leitura. O mais conhecido é o termômetro de mercúrio, que consiste em um bom capilar de mercúrio que se expande ao aquecer.
 Um termômetro com graduação em escalas Celsius e Fahrenheit. Fonte: Pixabay.
Um termômetro com graduação em escalas Celsius e Fahrenheit. Fonte: Pixabay. Em seguida, o capilar cheio de mercúrio é inserido em um tubo de vidro com uma escala e coloca contato com o corpo cuja temperatura deve ser medida até atingir o equilíbrio térmico e a temperatura de ambos é a mesma.
O que é necessário para fazer um termômetro?
Para começar, é necessário ter alguma propriedade termométrica, ou seja, que varia com a temperatura.
Por exemplo, um gás ou líquido como mercúrio, expanda ao aquecer, embora também sirva resistência elétrica, que emite calor quando cruzada por uma corrente. Em suma, qualquer propriedade termométrica que seja facilmente mensurável pode ser usada.
Se a temperatura t é diretamente proporcional à propriedade termométrica X, Então você pode escrever:
t = kx
Onde k É a constante da proporcionalidade a ser determinada quando duas temperaturas apropriadas são definidas e os valores correspondentes de X. Temperaturas apropriadas significa fácil de obter no laboratório.
Pode servir a você: tiro parabólico oblíquo: características, fórmulas, equações, exemplosUma vez que os casais foram estabelecidos (t1, X1) e (t2, X2), O intervalo entre eles é dividido em partes iguais, essas serão as notas.
Escalas de temperatura
A seleção das temperaturas necessárias para construir uma escala de temperatura é feita com o critério que eles são fáceis de obter no laboratório. Uma das escalas mais usadas do mundo é a escala Celsius, criada pelo cientista sueco Anders Celsius (1701-1744).
O 0 da escala Celsius é a temperatura na qual o gelo e a água líquida estão em equilíbrio na atmosfera de 1 pressão, enquanto a parada superior é escolhida quando a água líquida e o vapor de água estão igualmente em equilíbrio e na 1 atmosfera de pressão. Este intervalo é dividido em 100 graus, cada um dos quais é chamado grau centigrado.
Esta não é a única maneira de construir uma escala, muito menos. Existem outras escalas diferentes, como a escala Fahrenheit, na qual os intervalos foram escolhidos com outros valores. E há a escala Kelvin, que só tem uma parada mais baixa: o zero absoluto.
O zero absoluto corresponde à temperatura em que todo movimento de partículas em uma substância cessa completamente, no entanto, embora tenha sido bastante próximo, nenhuma substância ainda não foi resfriada ao zero absoluto.
Exemplos
Todos experimentam calor diariamente, direta ou indiretamente. Por exemplo, quando uma bebida quente é tomada, ao receber o sol do meio -dia, examinando a temperatura do motor de um carro, em uma sala cheia de pessoas e em inúmeras mais situações.

Na Terra, é necessário o calor para manter os processos da vida, tanto o que vem do sol e o que deixa o interior do planeta.
Da mesma forma, o clima é impulsionado por mudanças na energia térmica que ocorrem na atmosfera. O calor do sol não atinge o igual a todos os lugares, as latitudes equatoriais chegam mais do que os pólos, de modo que o ar mais quente dos trópicos se eleva e se move para o norte e sul, para alcançar o equilíbrio térmico que foi discutido antes.

Dessa forma, as correntes de ar são estabelecidas em diferentes velocidades, que transportam nuvens e chuva. Por outro lado, a colisão abrupta entre frentes quentes e frias causa fenômenos como tempestades, tornados e furacões.
Por outro lado, em um nível mais próximo, o calor pode não ser tão bem -vindo quanto um pôr do sol na praia. O calor causa problemas de operação em motores de carro e processadores de computador.
Pode servir a você: Lei Watt: O que é, exemplos, aplicativosTambém faz com que a eletricidade seja perdida nos cabos e materiais de condução, então o tratamento térmico é tão importante em todas as áreas da engenharia.
Exercícios
- Exercício 1
No rótulo de um doce lê que contribui com 275 calorias. Quanta energia em Joules é equivalente a este doce?
Solução
No começo, a caloria havia sido mencionada como uma unidade para o calor. Os alimentos contêm energia que geralmente é medida nessas unidades, mas comer calorias são na verdade quilocalorias.
A equivalência é a seguinte: 1 kcal = 4186 J, e conclui -se que o tratamento tem:
275 quilocalorias x 4186 Joule/Kilocaloria = 1.15 106 J.
- Exercício 2
100 g são aquecidos em um metal até 100 ° C e o colocam em um calorímetro com 300 g de água a 20 ° C. A temperatura adquirida pelo sistema quando atinge o saldo é 21.44 ° C. É solicitado para determinar o calor específico do metal, assumindo que o calorímetro não absorve o calor.
Solução
Nesta situação, o metal dá calor, que chamaremos de qBastão E um sinal (-) é colocado antes de indicar perda:
QBastão = mmetal .ECmetal. Δt
Por sua vez, a água do calorímetro absorve o calor, que será denotado como absorvido:
Qabsorvido = mágua .EC água . Δt
A energia é preservada, a partir da qual se segue que:
QBastão = Qabsorvido
Da declaração que você pode calcular Δt:
Metal: Δt = tfinal - Tinicial= (21.44 - 100) ºC = -78.56 ºC = -78.56 k.
Água: Δt = tfinal - Tinicial= (21.44 - 20) ºC = 1.44 ºC = 1.44 k.
Importante: 1 ºC tem o mesmo tamanho de 1 Kelvin. A diferença entre as duas escalas é que a escala Kelvin é absoluta (as notas de Kelvin são sempre positivas).
O calor específico da água a 20 ºC é 4186 J/kg. K E com isso você já pode calcular o calor absorvido:
Qabsorvido = mágua .EC água . ΔT = 300 x 10-3 kg . 4186 J/kg . K . 1.44 K = 1808.35 J.
Para concluir, o calor específico do metal é limpo:
EC metal = Q absorvido /-M metal . ΔT metal = 1808.35 J / -[(100 x 10-3 kg. (-78.56 k)] = 230.2 J/kg.K
Referências
- Bauer, w. 2011. Física para engenharia e ciências. Volume 1. McGraw Hill.
- Cuellar, J.PARA. FISCA II: Abordagem de competência. McGraw Hill.
- Kirkpatrick, l. 2007. Física: uma olhada no mundo. 6ta Edição abreviada. Cengage Learning.
- Cavaleiro, r. 2017. Física para cientistas e engenharia: uma abordagem de estratégia. Pearson.
- Tiptens, p. 2011. Física: conceitos e aplicações. 7ª edição. McGraw Hill
- « Características de cores passadas e significado
- Estrutura de metabisulfito de sódio (Na2S2O5), propriedades, usos, riscos »

