Fórmulas de calor cedido, como calculá -lo e exercícios resolvidos

- 3298
- 559
- Ernesto Bruen
Ele Calor cedido É a transferência de energia entre dois corpos em diferentes temperaturas. Aquele que está mais alta da temperatura dá calor ao que cuja temperatura é menor. Se um corpo produz ou absorve calor, sua temperatura ou sua condição física podem variar dependendo da massa e das características do material de que é feito.
Um bom exemplo está em uma xícara de café fumegante. A colher de metal com o qual o açúcar é agitado. Se for deixado dentro da xícara de tempo suficiente, café e colher de chá de metal acabarão. Algum calor terá passado para o meio ambiente, uma vez que o sistema não está isolado.
 O café e a colher de chá tornam -se em equilíbrio térmico por um tempo. Fonte: Pixabay.
O café e a colher de chá tornam -se em equilíbrio térmico por um tempo. Fonte: Pixabay. Quando as temperaturas são comparadas, o Equilíbrio térmico.
Se o mesmo teste foi feito com uma colher de chá de plástico, certamente notaria que não aquece tão rápido quanto o metal, mas eventualmente também se tornará em equilíbrio com o café e tudo o que o rodeia.
Isso ocorre porque o metal leva o calor melhor do que o plástico. Por outro lado, certamente o café dá calor a uma taxa diferente de chocolate quente ou outra bebida. Então, o calor atribuído ou absorvido por cada objeto depende de qual material ou substância é feita.
[TOC]
O que é e fórmulas
O calor sempre se refere ao fluxo ou trânsito de energia entre um objeto e outro, devido à diferença de temperatura.
É por isso que se fala em calor atribuído ou absorvido, pois, ao adicionar ou extrair calor ou energia de alguma forma, é possível modificar a temperatura de um elemento.
Geralmente é chamado de quantidade de calor que o objeto mais quente produz. Este valor é proporcional à massa do referido objeto. Um corpo com grande massa é capaz de desistir de mais calor do que outra massa menor.
Pode servir a você: Millikan Experiment: Procedimento, Explicação, ImportânciaA diferença de temperatura Δt
Outro fator importante no cálculo do calor atribuído é a diferença de temperatura que o objeto que produz as experiências de calor. É denotado como δT E é calculado assim:
Δt = tF - Tqualquer
Finalmente, a quantidade de calor atribuída também depende da natureza e das características do objeto, que são resumidas quantitativamente em uma constante chamada Calor específico de calor, denotado como c.
Então, finalmente, a expressão para o calor atribuída é a seguinte:
QBastão = - m.c.ΔT
O rendimento é simbolizado com um sinal negativo.
A capacidade específica de calor e calor de uma substância
O calor específico é a quantidade de calor necessária para elevar a temperatura de 1 g de substância em 1 ° C. É uma propriedade intrínseca do material. Suas unidades no sistema internacional são: Joule/kg . K (joule entre quilograma x temperatura em graus Kelvin).
A capacidade de calor C é um conceito ligado, mas ligeiramente diferente, uma vez que a massa do objeto intervém. A capacidade de calor é definida da seguinte forma:
C = mc
Suas unidades em S.Yo. Eles são joule/k. Para que o calor cedido também possa ser expresso de maneira equivalente como:
Q = -C. ΔT
Como calcular?
Para calcular o calor atribuído por um objeto, é necessário saber o seguinte:
- O calor específico da substância que dá o calor.
- A massa da referida substância
- A temperatura final para obter
Os valores de calor específicos para muitos materiais foram determinados experimentalmente e estão disponíveis em tabelas.
Calorimetria
Agora, se esse valor não for conhecido, é possível obtê -lo com a ajuda de um termômetro e água em um recipiente isolado termicamente: o calorímetro. Um esquema deste dispositivo é mostrado na figura que acompanha o Exercício 1.
Uma amostra da substância é imersa a uma certa temperatura em uma quantidade de água que já foi medida. A temperatura final é medida e, com os valores obtidos, o calor específico do material é determinado.
Pode servir a você: erro aleatório: fórmula e equações, cálculo, exemplos, exercíciosComparando o resultado com os valores tabulados, pode -se saber que substância é. Este procedimento é chamado calorimetria.
O balanço de calor é realizado pela conservação de energia:
Q Bastão + Q absorvido = 0
Exercícios resolvidos
Exercício 1
Uma peça 0 de 0.35 kg a uma temperatura de 150 ºC em 500 ml de água a uma temperatura de 25 º C. Encontrar:
a) A temperatura final de equilíbrio
b) quanto fluxos de calor nesse processo?
Dados
ccobre = 385 J/kg . ºC
cágua = 4180 J/kg . ºC
Densidade da água: 1000 kg/m3
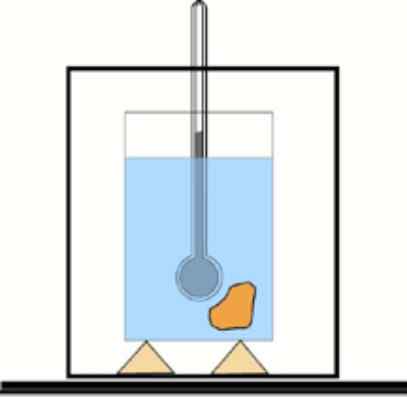 Esquema básico de calorímetro: um recipiente com água isolada e um termômetro para medir mudanças de temperatura. LFIENTE: DR. Tilahun Tesfaye [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]
Esquema básico de calorímetro: um recipiente com água isolada e um termômetro para medir mudanças de temperatura. LFIENTE: DR. Tilahun Tesfaye [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] Solução
a) O cobre dá calor enquanto a água a absorve. À medida que o sistema é considerado fechado, apenas a água e a amostra intervêm no balanço térmico:
Q Bastão = Q absorvido
Por outro lado, é necessário calcular a massa de 500 ml de água:
500 ml = 0.5 L = 0.0005 m3
Com esses dados, a massa da água é calculada:
massa = densidade x volume = 1000 kg/m3 . 0.0005 m3 = 0.5 kg
A equação do calor é levantada em cada substância:
QBastão = -mcobre . ccobre. ΔT = -0.35 kg . 385 J/kg .ºC . (TF -150 ºC) = -134.75 (tF - 150) J
Qabsorvido = mágua . cágua. ΔT = 0.5 kg . 4186 J/kg . ºC .(TF -25 ºC) = 2093 (tF -25) J
Equalizando os resultados que você tem:
2093 (tF - 25) = -134.75 (tF - 150)
É uma equação linear com um desconhecido, cuja solução é:
TF = 32.56 ºC
b) A quantidade de calor fluindo é o calor atribuído ou o calor absorvido:
Q Bastão = - 134.75 (32.56 - 150) J = 15823 J
Q absorvido = 2093 (32.56 - 25) J = 15823 J
Exercício 2
Uma peça de cobre de 100 g é aquecida em um forno a uma temperatura Tqualquer E então é introduzido em um calorímetro de cobre de 15 g que contém 200 g de água a 16 º C. A temperatura final uma vez em equilíbrio é de 38 º C. Quando o calorímetro e seu conteúdo são pesados, verifica -se que eu evaporei.2 g de água qual era a temperatura inicial tqualquer?
Pode servir a você: Hole Worm: História, Teoria, Tipos, FormaçãoDados: O calor latente da vaporização de água é lv = 2257 kJ/kg
Solução
Este exercício difere do anterior, pois deve -se considerar que o calorímetro também absorve o calor. O calor atribuído pela peça de cobre é investido em todos os seguintes:
- Aqueça a água do calorímetro (200 g)
- Aqueça o cobre do qual o calorímetro é feito (150 g)
- Evaporação 1.2 gramas de água (para uma mudança de fase, você também precisa de energia).
QBastão = -100 x 1 x 10 -3 kg. 385 J/kg . ºC. (38 - Tqualquer ) ºC = -38.5. (38 - Tqualquer) J
Q absorvido por ele calorímetro = Q absorvido pela água + Q vaporização + Q absorvido por cobre
0.2 kg .4186 J/kg ºC .(38 - 16 ºC) + 1.2 x 10-3 kg. 2257000 J/kg +0.150 kg .385 J/kg .ºC.(38 - 16 ºC) =
18418.4 +2708.4 + 1270.5 J = 22397.3 j
Portanto:
-38.5. (38 - Tqualquer) = 22397.3
Tqualquer = 619.7 ºC
O calor necessário para carregar o 1 também poderia ter sido considerado.2 g de água até 100 º C, mas é uma quantidade bastante pequena em comparação.
Referências
- Giancoli, d. 2006. Física: Princípios com aplicações. 6º. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, l. 2007. Física: uma olhada no mundo. 6ta Edição abreviada. Cengage Learning. 156 - 164.
- Rex, a. 2011. Fundamentos da Física. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Física da Universidade com Física Moderna. 14º. Ed. Volume 1. 556 - 553.
- Serway, r., Vulle, c. 2011. Fundamentos da Física. 9n / D Cengage Learning.
- « Conceito de calor sensível, fórmulas e exercícios resolvidos
- Definição da plataforma fatorial, fórmulas e exercícios »

