Fórmulas absorvidas pelo calor, como calculá -lo e resolver exercícios

- 4205
- 1190
- Dennis Heidenreich
Ele calor absorvido É definido como a transferência de energia entre dois corpos em diferentes temperaturas. Aquele com temperatura mais baixa absorve o calor do que em uma temperatura mais alta. Quando isso acontece, a energia térmica da substância que absorve o calor aumenta e as partículas que a compõem vibram mais rapidamente, aumentando sua energia cinética.
Isso pode se traduzir em um aumento de temperatura ou uma mudança de estado. Por exemplo, mova -se de sólido para líquido, como gelo quando derrete em contato com água ou refrigerante à temperatura ambiente.
 A colher de chá de metal absorve calor de café quente. Fonte: Pixabay.
A colher de chá de metal absorve calor de café quente. Fonte: Pixabay. Graças ao calor, também é possível que os objetos mudem suas dimensões. A dilatação térmica é um bom exemplo desse fenômeno. Quando a maioria das substâncias é aquecida, elas geralmente experimentam um aumento em suas dimensões.
Uma exceção a isso é água. A mesma quantidade de água líquida aumenta seu volume quando resfriado abaixo de 4 ºC. Além disso, as mudanças de temperatura também podem sofrer mudanças no nível de sua densidade, algo também muito observável no caso da água.
[TOC]
O que é e fórmulas
No caso de energia em trânsito, as unidades do calor absorvidas são os joules. No entanto, por muito tempo o calor tinha suas próprias unidades: a caloria.
Ainda hoje, esta unidade é usada para quantificar o conteúdo energético dos alimentos, embora, na realidade.
Calorias
A caloria, abreviada como Lima, É a quantidade de calor necessária para elevar a temperatura de 1 grama de água em 1 º C.
No século XIX, Sir James Prescott Joule (1818 - 1889) realizou um famoso experimento no qual ele conseguiu transformar o trabalho mecânico em calor, obtendo a seguinte equivalência:
1 caloria = 4.186 Joules
Nas unidades britânicas, a unidade de calor é chamada BTU (Unidade Térmica Britânica), que é definido como a quantidade de calor necessária para elevar a temperatura de um quilo de água em 1 ºF.
Pode servir a você: Curva de calibração: para que é, como fazer isso, exemplosA equivalência entre unidades é a seguinte:
1 BTU = 252 calorias
O problema com essas unidades antigas é que a quantidade de calor depende da temperatura. Ou seja, não é o mesmo que é necessário para passar de 70 ºC para 75 ° C do que o necessário para aquecer a água de 9 ° C a 10 ºC, por exemplo.
É por isso que a definição contempla intervalos bem definidos: 14.5 a 15.5 ° C e 63 a 64 ° F para calorias e BTU, respectivamente.
O que depende da quantidade de calor absorvida?
A quantidade de calor absorvido que coleta um material depende de vários fatores:
- Massa. Quanto maior a massa, mais calor é capaz de absorver.
- Características da substância. Existem substâncias que, dependendo de sua estrutura molecular ou atômica, são capazes de absorver mais calor do que outros.
- Temperatura. É necessário adicionar mais calor para obter uma temperatura mais alta.
A quantidade de calor, indicada como Q, É proporcional aos fatores descritos. Portanto, você pode escrever como:
Q = m.c.ΔT
Onde m É a massa do objeto, c é uma constante chamada calor específico, uma propriedade intrínseca da substância e δT É a variação de temperatura alcançada absorvendo o calor.
Δt = tF - Tqualquer
Essa diferença tem um sinal positivo, pois quando absorve o calor TF > Tqualquer. Isso acontece a menos que a substância esteja experimentando uma mudança de fase, como a água quando o fluido de vapor passa. Quando a água ferve, sua temperatura permanece constante em aproximadamente 100 º C, independentemente da rapidez.
Como calcular?
Entrando em contato com dois objetos a uma temperatura diferente, depois de um tempo ambos atingem o equilíbrio térmico. Portanto, as temperaturas são equalizadas e a transferência de calor cessa. O mesmo acontece se mais de dois objetos estiverem em contato. Depois de um certo tempo, todos estarão na mesma temperatura.
Pode servir a você: Magnetização: Orbital e Moment Magnético, ExemplosSupondo que os objetos no contato formem um sistema fechado, do qual o calor não pode escapar, o princípio da conservação de energia é aplicado, portanto, pode -se afirmar que:
Q absorvido = - q Bastão
Isso representa um balanço energético, semelhante ao das entradas e despesas de uma pessoa. É por isso que o calor cedido tem um sinal negativo, pois para o objeto que rende, a temperatura final é menor que a inicial. Portanto:
Δt = tF - Tqualquer < 0
A equação q absorvido = - q Bastão É usado sempre que dois objetos estão em contato.
O balanço energético
Para executar o balanço energético, é necessário distinguir os objetos que absorvem o calor daqueles que produzem: então:
Σ qk= 0
Isto é, a soma dos ganhos e perdas de energia em um sistema fechado deve ser igual a 0.
O calor específico de uma substância
Para calcular a quantidade de calor absorvido, você precisa conhecer o calor específico de cada substância participante. Esta é a quantidade de calor necessária para elevar a temperatura de 1 g de material em 1 º C. Suas unidades no sistema internacional são: joule/kg . K.
Existem tabelas com o calor específico de inúmeras substâncias, geralmente calculadas usando um calorímetro ou ferramentas semelhantes.
Um exemplo de como calcular o calor específico de um material
250 calorias são necessárias para elevar a temperatura de um anel de metal de 20 a 30 ºC. Se o anel tiver uma massa de 90 g. Qual é o calor específico de calor nas unidades SI?
Solução
As unidades são convertidas pela primeira vez:
Q = 250 calorias = 1046.5 J
M = 90 g = 90 x 10-3 kg
Pode servir a você: choques elásticos: em uma dimensão, casos especiais, exercícios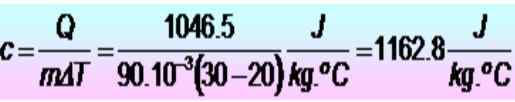
Exercício resolvido
Um copo de alumínio contém 225 g de água e um agitador de cobre de 40 g, tudo a 27 ° C. Uma amostra de 400 g de prata a uma temperatura inicial de 87 ° C é colocada na água.
O agitador é usado para mexer a mistura até atingir sua temperatura final de equilíbrio de 32 ° C. Calcule a massa do copo de alumínio, considerando que não há perdas de calor em direção ao meio ambiente.
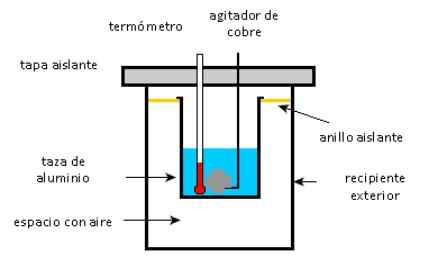 Esquema de um calorímetro. Fonte: Solidswiki.
Esquema de um calorímetro. Fonte: Solidswiki. Abordagem
Como afirmado acima, é importante distinguir os objetos que produzem calor daqueles que absorvem:
- Copo de alumínio, cobre e agitador de água absorver calor.
- A amostra de prata produz calor.
Dados
Os aquecimentos específicos de cada substância são fornecidos:
- Prata: C = 234 J/kg. ºC
- Cobre: c = 387 J/kg. ºC
- Alumínio c = 900 j/kg. ºC
- Água C = 4186 J/kg. ºC
O calor absorvido ou atribuído por cada substância é calculado pela equação:
Q = m.c.λT
Solução
Prata
Q Bastão = 400 x 10 -3 . 234 x (32 - 87) J = -5148 J
Agitador de cobre
Q absorvido = 40 x 10 -3 . 387 x (32 - 27) j = 77.4 J
Água
Q absorvido = 225 x 10 -3 . 4186 x (32 - 27) j = 4709.25 J
Copo de alumínio
Q absorvido = m alumínio . 900 x (32 - 27) J = 4500 .m alumínio
Fazendo uso de:
Σ qk= 0
77.4 + 4709.25 + 4500 .m alumínio = - (-5148)
Finalmente, a massa de alumínio é liberada:
m alumínio = 0.0803 kg = 80.3 g
Referências
- Giancoli, d. 2006. Física: Princípios com aplicações. 6º. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, l. 2007. Física: uma olhada no mundo. 6ta Edição abreviada. Cengage Learning. 156 - 164.
- Rex, a. 2011. Fundamentos da Física. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Física da Universidade com Física Moderna. 14º. Volume 1. 556 - 553.
- Serway, r., Vulle, c. 2011. Fundamentos da Física. 9n / D Cengage Learning. 362 - 374
- « Estrutura de adenina, biossíntese, funções
- Características, tipos, funções e exemplos de Macromolecules »

