Estrutura butanona, propriedades e usos
- 1593
- 319
- Tim Mann
O Butanone É um composto orgânico, especificamente uma cetona, cuja fórmula química é Cho3CH2Coch3. Sua aparência é a de um líquido incolor usado fundamentalmente como solvente. Tem semelhante às propriedades de acetona, mas ferva a uma temperatura mais alta e evapora mais lentamente.
É produzido pela desidrogenação catalítica de 2-butanol (composto quiral). No entanto, está em estado natural na composição de algumas frutas. Faz parte das emanações dos tubos de escape dos veículos e é um componente da fumaça do tabaco.
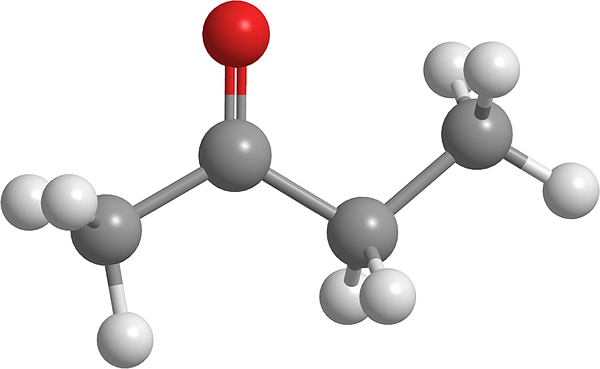
 Molécula de butanona. Fonte: Pixabay.
Molécula de butanona. Fonte: Pixabay. É depois da acetona a mais simples desta família de compostos orgânicos. Butnononona causa irritação nos olhos e nariz. Em dose extraordinariamente alta, pode causar irritação da mucosa pulmonar. Por outro lado, esse líquido é considerado um agente precursor de narcóticos.
Butanona tem grande solubilidade na água; Mas também é muito solúvel em solventes orgânicos como etanol, éter, acetona, benzeno e clorofórmio. Isso pode ser explicado porque seu valor do registro (0,29) para o coeficiente de partição de octano/água é baixo.
[TOC]
Estrutura butanona
Na imagem superior, a molécula butanona é mostrada com um modelo de esferas e barras. O átomo de oxigênio do grupo carbonil (esfera vermelha) pode ser vista no segundo carbono. Este grupo, c = O, é responsável por conferir um momento dipolar permanente à molécula.
Butanona, visão estruturalmente, nada mais é do que uma acetona à qual um grupo de metileno foi adicionado, CH2. Tendo mais carbonos, o momento dipolar é menor em comparação com o da acetona; Mas sua maior massa molecular faz com que ferva a uma temperatura mais alta.
Essa molécula, como outras cetonas, carece da possibilidade de formar pontes de hidrogênio; E, portanto, suas interações dipolo-dipolo não são tão fortes.
Pode atendê -lo: Emulsificante: Processo de Emulsão, Aspectos Moleculares, AplicaçõesÉ por isso que é um líquido volátil. Quando a temperatura cai (-86,6 ° C), seus dipolos fracos são aqueles que guiam suas moléculas para formar um cristal. Além disso, também pode ser comentado que o butanone é estruturalmente assimétrico.
Propriedades
Fórmula molecular
C4H8Ou cap3Coch2CH3
Nomes
- Butanone.
- 2-butanona.
- Butan -2 -ona.
- Metil Ethil Cetona.
Massa molar
72.107 g/mol.
Descrição física
Líquido incolor.
Cheiro
Perfumado para hortelã, moderadamente forte.
Ponto de ebulição
79,59 ºC a 760 mmHg.
Ponto de fusão
-86.6 ºC.
ponto de ignição
-9 ºC (copo fechado).
Solubilidade em água
29 g /100 ml a 20 ºC. Embora seu momento dipolar seja menor que o da acetona, ele ainda pode interagir em um excelente grau com moléculas de água. Delas recebe pontes de hidrogênio: (CH3) (CH2CH3) C = o-hah. Por causa disso é muito solúvel na água.
Solubilidade em solventes orgânicos
Solúvel em benzeno, álcool e éter; miscível com óleos, etanol, éter, acetona, benzeno e clorofórmio. Observe que o butanona é solúvel em uma ampla variedade de solventes.
Densidade
0,7997 g/cm3 a 25 ºC.
Densidade do vapor
2,41 (em relação à água = 1).
Pressão de vapor
90,6 mmHg a 25 ºC.
Coeficiente de partição de octanol/água
Log p = 0,29
Temperatura de auto -ignição
505 ºC.
Decomposição
Decompõe -se por processos fotoquímicos por oxidação por radical hidroxila livre. Quando aquecido para decomposição emite uma fumaça de hectare.
Gosma
0,40 cPoise a 25 ºC.
Calor de combustão
2.444,1 kJ/mol a 25 ° C.
Calor de vaporização
31,30 kJ/mol no ponto de ebulição; e 34,79 kJ/mol a 25 ° C.
Pode atendê -lo: Lei Geral de GásTensão superficial
23,97 mn/m a 25 ºC.
Potencial de ionização
0,54 eV.
Limiar de cheiro
Cheiro baixo: 0,735 mg/m3.
Alto cheiro: 147,5 mg/m3.
Índice de refração
1.788 a 20 ºC.
Constante de dissociação
PKA = 14,70.
Estabilidade
Estável, mas altamente inflamável. Incompatível com agentes oxidantes, bases e agentes reduzidos fortes. A umidade deve ser evitada.
Formulários
Solvente
Butanona é usada como solvente na elaboração de revestimentos de superfície, fabricação de poeira sem fumaça, elaboração de resinas coloridas e na eliminação da acumulação de gordura produzida por lubrificantes.
Além disso, é usado na elaboração de:
- Couro artificial.
- Gomas.
- Lacas.
- Vernizes.
- Cola.
- Solventes.
- Estacas de tinta.
- Adesivos.
- Cimentos de plástico.
- Selantes.
- Fitas magnéticas.
- Papel transparente.
- Tintas impressas.
- Cosméticos e produtos farmacêuticos.
Também é usado como um solvente para a negligência de superfícies metálicas, produtos de limpeza de equipamentos eletrônicos e extração de gordura. Serve para extração de madeira dura e óleo vegetal.
É um ingrediente inerte na elaboração de pesticidas e na fabricação de acetato e nitrato de celulose.
É usado como solvente de extração no processamento de alimentos e ingredientes alimentares; Por exemplo, no fracionamento de gorduras e óleos, bem como no processo de descafeinado do café. Também é usado como solvente nos marcadores usados em placas brancas.
Reagente
- Butanona é usada como fotoiniciador solúvel em água.
- Ele condensa com o formaldeído para produzir isopropenil cetona.
- Experimente a autocodensação para a produção de etil amylo Cetona.
- Reage com citral para obter componentes de perfume, como metilpseudoionona.
Pode atendê -lo: calor de reação- Ele intervém como um catalisador na produção de hidracina.
- Além disso, é um precursor do peróxido de metil etil ctona, que é um catalisador para algumas reações de polimerização.
Cimento plástico
Butanone tem aplicação como agente de solda plástica, com uso na montagem de modelos de escala de poliestireno. Butnonona dissolve poliestireno, permitindo que as bordas se juntem quando uma nova polimerização ocorre. Este comportamento é de cimento e não de cola.
Outros usos
Butanona é usada como esterilizador de esporos de bactérias em instrumentos de cirurgia, agulhas, injetores hipodérmicos e instrumentos dentários.
É usado como um agente aromatizante de alimentos em concentrações muito baixas; Por exemplo, em bebidas alcoólicas, a concentração é de 20 ppm; em produtos assados, 12,7 ppm; As carnes têm cerca de 26,5 ppm; borracha de mascar, 0,63 ppm; e em gorduras e óleos, 1,0 ppm.
E finalmente, butanona é usada na separação do grupo de hemoproteínas apoproteínas em hemoproteínas.
Referências
- Morrison, r. T. e boyd, r, n. (1987). Quimica Organica. 5ta Edição. Interamericano Editorial Addison-Wesley.
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. Aminas. (10ºEdição.). Wiley Plus.
- Centro Nacional de Informações sobre Biotecnologia. (2019). Banco de dados pubchem de metil etil -cetona. CID = 6569. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Wikipedia. (2019). Butanone. Recuperado de: em.Wikipedia.org
- Sociedade Real de Química. (2015). Butanone. Chemspider. Recuperado de: chemspider.com
- Arlem Cheprasov. (2019). O que é butanone? Fórmula e uso. Estudar. Recuperado de: estudo.com
- Ben Verve. (17 de maio de 2017). Butanone. Mundo de química. Recuperado de: químicaworld.com

