Estrutura de bissulfito de sódio (NAHSO3), propriedades, usos, obtenção
- 3927
- 476
- Orlando MacGyver
Ele bissulfito de sódio É um sólido inorgânico formado por um Íon Sodium na+ e um íon bissulfito HSO3-. Sua fórmula química é nahso3. É um sólido branco cristalino e, para suas propriedades antioxidantes.
O nahso3 É um composto químico redutor, que é o oposto de oxidação e, por esse motivo, atua como um antioxidante em muitas de suas aplicações, como produtos comestíveis, pois impede sua deterioração.
 Algumas geléias comerciais contêm bissulfito de sódio nahso3. Autor: OpenClipart-Vectors. Fonte: Pixabay.
Algumas geléias comerciais contêm bissulfito de sódio nahso3. Autor: OpenClipart-Vectors. Fonte: Pixabay. No entanto, esse uso foi questionado porque os casos de asma foram relatados em pessoas depois de terem comido alimentos contendo bissulfito de sódio. Diz -se até destruir a vitamina B1 destes.
As organizações internacionais de saúde restringiram seu uso às microcontidades em alimentos.
No entanto, o bissulfito de sódio tem muitos outros usos, como na obtenção de iodo, como anti -infecção, para os tecidos de branqueamento, para a digestão de madeira durante a preparação da polpa de papel, como desinfetante de barris de cerveja e vinho, etc.
[TOC]
Estrutura química
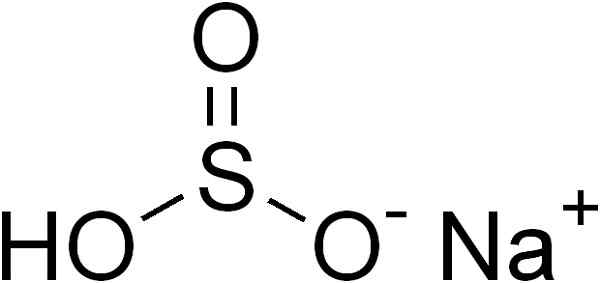
O bissulfito de sódio é formado por um cátion de sódio+ e um ânion bissulfito HSO3-.
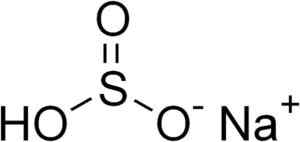 Estrutura química de bissulfito de sódio3. Edgar181 [domínio público]. Fonte: Wikimedia Commons.
Estrutura química de bissulfito de sódio3. Edgar181 [domínio público]. Fonte: Wikimedia Commons. Em soluções aquosas, o bissulfito forma 4 espécies. Em solução diluída, há um equilíbrio entre as estruturas mostradas abaixo:
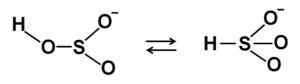 Estruturas de íons bissulfitos HSO3- Em solução aquosa diluída. Autor: Marilú Stea.
Estruturas de íons bissulfitos HSO3- Em solução aquosa diluída. Autor: Marilú Stea. Quando a concentração aumenta, duas moléculas de bissulfito interagem entre si, formando os íons pirossulfito s2QUALQUER52-:
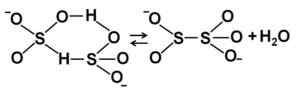 Estruturas de íons bissulfitos em solução aquosa concentrada. Autor: Marilú Stea.
Estruturas de íons bissulfitos em solução aquosa concentrada. Autor: Marilú Stea. Nomenclatura
-Bissulfito de sódio
-Hidrogenossulfito de sódio
-Hidrossulfito de sódio.
Propriedades
Estado físico
Sólido branco cristalino.
Peso molecular
104,06 g/mol
Ponto de fusão
Se decompõe.
Densidade
1,48 g/cm3 A 20 ºC.
Solubilidade
Solúvel em água: 29 g/100 g de água.
ph
Suas soluções são ácidas, com um pH entre 2,5 e 5,5.
Propriedades quimicas
Em solução aquosa de bissulfito de sódio3 está separado em seus íons: o cátion de sódio na+ e o ânion bissulfito HSO3-.
Se o bissulfito de sódio for exposto ao ar perde alguns2 e oxida lentamente o sulfato2SW4.
Pode atendê -lo: ácido gálico: estrutura, propriedades, obtenção, usosSe aquecido até que sua decomposição emite óxidos de enxofre e monóxido de sódio.
É um agente redutor, que é o oposto do oxidante. E por esse motivo, pode se comportar como antioxidante.
Tem um leve cheiro de enxofre. Não é inflamável.
Riscos
Nahso bissulfito de sódio3 É um couro forte e tecido irritante. A poeira irrita os olhos, nariz e garganta. Ingestão irrita o estômago. Grandes doses podem causar cólicas violentas, diarréia, depressão e morte.
Não é combustível, mas é aquecido produz gases irritantes e tóxicos.
Obtenção
É preparado saturando uma solução de carbonato de sódio na2Co3 Com dióxido de enxofre então2 e cristaliza na solução.
Formulários
Na indústria de celulose e papel
O nahso3 É usado na digestão da madeira, para que possa se tornar papel. Também serve como polpa mais branca.
Também é usado para eliminar o cloro quando a polpa de papel foi branqueada com isso.
Na indústria de alimentos
O bissulfito de sódio para sua propriedade redutora atua como um antioxidante.
É usado como conservante em uma grande quantidade de alimentos e bebidas, incluindo vinho e cerveja, para evitar sua deterioração e melhorar o sabor.
Serve para alimentos branqueados, como certos amidos comestíveis.
Reduz ou impede a deterioração dos alimentos, permite condicionar a massa usada em alimentos assados e serve para suavizar grãos de milho durante a moagem úmida, entre outros usos.
Além de controlar a fermentação de vinho e cerveja, atua como um anti -séptico em sua elaboração, porque serve como esterilizante e fungicida em barris e dentes.
 Os barris de vinho ou cerveja às vezes são desinfetados com bissulfito de sódio3. Autor: Clker-Free-Vector-Imagens. Fonte: Pixabay.
Os barris de vinho ou cerveja às vezes são desinfetados com bissulfito de sódio3. Autor: Clker-Free-Vector-Imagens. Fonte: Pixabay. Em frutas secas, está em concentrações acima de 100 ppm (ppm significa "peças por milhão"), em muitos outros alimentos, está em concentrações entre 10 e 100 ppm, como batatas congeladas e secas, picles, molhos e geléias.
 Alimentos em conserva comerciais geralmente contêm bissulfito de sódio nahso3. Autor: mix de fotos. Fonte: Pixabay.
Alimentos em conserva comerciais geralmente contêm bissulfito de sódio nahso3. Autor: mix de fotos. Fonte: Pixabay. Controvérsia sobre seu uso na comida
Houve alguma preocupação com os efeitos tóxicos imediatos e a longo prazo de bissulfito de sódio na comida. Existem opiniões divergentes.
Pode atendê -lo: ferrocianeto de potássioHá relatos de reações adversas de pacientes com asma, que é uma doença respiratória, após a ingestão de mantimentos com Nahso3. Outras fontes indicam que o íon bissulfito pode destruir a vitamina B1 ou a tiamina.
 Menina aspirando a um remédio para aliviar a asma. Autor: OpenClipart-Vectors. Fonte: Pixabay.
Menina aspirando a um remédio para aliviar a asma. Autor: OpenClipart-Vectors. Fonte: Pixabay. No entanto, certos pesquisadores em 1985 descobriram que o bissulfito de sódio serve para proteger contra agentes químicos e inibe ou impede a transformação das células em câncer. As doses baixas são as melhores.
Esse efeito protetor foi explicado com base em suas propriedades reduzidas ou antioxidantes e que dessa maneira poderia atacar os radicais livres.
Por outro lado, a Organização Mundial da Saúde, ou quem (por seu acrônimo para o inglês Organização Mundial de Saúde), recomenda como um nível aceitável de ingestão diária cerca de 0,7 mg/kg da pessoa.
Isso significa que é recomendado não exceder esse valor.
A Administração de Alimentos e Medicina dos Estados Unidos, ou USFDA (sigla em inglês Administração de alimentos e medicamentos nos EUA), ele classificou o bissulfito de sódio como "geralmente reconhecido como seguro".
Em aplicações agrícolas
Usado em baixas concentrações o Nahso3 Serve como um regulador de crescimento de plantas, para melhorar a fotossíntese e promover o desempenho da colheita.
Este objetivo foi testado em vários tipos de plantas, como plantas de morango e chá.
 As plantas de morango melhoram seu desempenho com pequenas quantidades de Nahso3 Em água de irrigação. Autor: Alyssapy. Fonte: Pixabay.
As plantas de morango melhoram seu desempenho com pequenas quantidades de Nahso3 Em água de irrigação. Autor: Alyssapy. Fonte: Pixabay. É o ingrediente ativo de muitos pesticidas e biocidas.
Em ambientes aquáticos, também pode acelerar a transformação de certos herbicidas em produtos menos tóxicos, eliminando o cloro.
Na obtenção de iodo
O nahso3 É o composto redutor usado para liberar iodinus de sódio Naio3. Esta é uma das maneiras de obter iodo de fontes como o nitro chileno ou algumas águas de Salinas.
Depois de cristalizar o nitrato de sódio da solução de nitrato do chile bruto, há uma solução NAIO3 que é tratado com bissulfito de sódio3, gerando iodo grátis.
2 NAIO3 + 5 Nahso3 → 3 Nahso4 + N / D2SW4 + Yo2
Na indústria de móveis e madeira
O nahso3 Ele foi testado para modificar as proteínas de soja e melhorar suas propriedades de adesão com madeira com o objetivo de pastar pedaços de madeira um do outro para se preparar, por exemplo, aglomerados, papelão de madeira ou papelão de pedra, contador -shaped, etc. Tudo para móveis ou placas, entre várias aplicações.
Pode atendê -lo: hidróxido de lítio (lioh) Aglomerado de lascas ou restos de madeira. Autor: Titus Tschardke [Domínio Público]. Fonte: Wikimedia Commons.
Aglomerado de lascas ou restos de madeira. Autor: Titus Tschardke [Domínio Público]. Fonte: Wikimedia Commons. Isso é feito para substituir os adesivos tradicionais baseados em formaldeído, porque tanto em seu processo de fabricação quanto durante o uso tendem a formalizar livremente a atmosfera, que é um composto tóxico.
O bissulfito de sódio melhora o conteúdo sólido do adesivo da proteína da soja e diminui a viscosidade disso, melhorando sua fluidez, para penetrar nos poros da madeira, aumentando sua coesão com este e entre as peças.
Adesivo de proteína de soja modificado com Nahso3 Tem boa resistência à água e excelente estabilidade de armazenamento devido à ação antioxidante do bissulfito de sódio.
Isso confirma que os adesivos de proteína de soja modificados com Nahso3 Eles são comparáveis aos adesivos baseados em formaldeído e podem ser usados na indústria de móveis e madeira, sendo menos poluente.
Em várias aplicações
Possui múltiplos usos, geralmente com base em suas propriedades redutoras (que é o oposto do oxidante). Aqui estão alguns aplicativos.
-Em fotografia.
-No curtidor de couro, para remover o cabelo das peles.
-Usos terapêuticos: anti -infecciosos. É usado como antioxidante em algumas gotas para -ojos.
-Em extração de gás natural por fratura hidráulica.
-Na coloração da fibra, é usado para a preparação de banhos de banheira quente ou fria, para solubilizar certos corantes ou corantes.
-Como uma redução na roupa ou em branqueamento, para alvejar lã, seda e fibras de plantas.
-Em Laboratórios de Química para remover manchas de pele e roupas. Nos laboratórios de bioquímica como conservante ou soluções fluidas que podem ser deterioradas ao longo do tempo. Como um reagente químico.
-Para coagulação de látex de borracha.
-Na indústria cosmética como um antioxidante.
-Desinfetante e alvejante.
-No tratamento de águas residuais para eliminar o cloro usado na fase final da desinfecção e poder baixar as águas já tratadas com o meio ambiente.
 Tanque de bissulfito de sódio em uma estação de tratamento de águas residuais na Califórnia, onde é usado para eliminar o excesso de cloro antes que as águas purificadas sejam baixadas no meio ambiente. Grendelkhan [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons.
Tanque de bissulfito de sódio em uma estação de tratamento de águas residuais na Califórnia, onde é usado para eliminar o excesso de cloro antes que as águas purificadas sejam baixadas no meio ambiente. Grendelkhan [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons. Referências
- OU.S. Biblioteca Nacional de Medicina. (2019). Bissulfito de sódio. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Qi, g. et al. (2013). Adesão e propriedades físico -químicas da proteína Ser modificada por bissulfito de sódio. J Am Oil Chem Soc (2013) 90: 1917-1926. Recuperado de AOCs.Biblioteca online.Wiley.com.
- Borek, c. et al. (1985). Bissulfito de sódio protege contra transformação radiogogênica e quimicamente induzida no embrião de hamster e nas células C3H/10T-1/2. Toxicol Ind Health 1985Sep; 1 (1): 69-74. Recuperado de periódicos.SagePub.com.
- Friedler, e. et al. (2015). Uma abordagem contínua de monitoramento ativo para identificar conexões cruzadas entre água potável e sistemas de distribuição de efluentes. Ambiente Monit avaliado (2015) 187: 131. Link recuperado.Springer.com.
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- Programa de água limpa Sunnyvale. (2019). Planta mestre da planta de controle de poluição da água. Recuperado da água SunnyValeclean.com.
- Barros Santos, C. (2008). Aditivos na alimentação dos espanhóis e na legislação que regula sua autorização e uso. Visão de livros. Recuperado de livros.Google.co.ir.

