Bicarbonato de cálcio

- 2268
- 471
- Alfred Kub
 O bicarbonato de cálcio é um sal inorgânico do grupo de bicarbonato
O bicarbonato de cálcio é um sal inorgânico do grupo de bicarbonato O que é bicarbonato de cálcio?
Ele bicarbonato de cálcio É um sal inorgânico com fórmula química CA (HCO3)2. Ele se origina na natureza do carbonato de cálcio presente em pedras de calcário e minerais, como calcita.
O bicarbonato de cálcio é mais solúvel em água do que carbonato de cálcio. Esse recurso permitiu a formação de sistemas karst em rochas de calcário e na estruturação das cavernas.
A água subterrânea que atravessa as rachaduras está saturando em seu deslocamento de dióxido de carbono (CO2).
Essas águas corroem as rochas de calcário liberando carbonato de cálcio (caco3) que o bicarbonato de cálcio se formará, de acordo com a seguinte reação:
Ladrão3(s) +CO2(g) +h2Ou (L) => CA (HCO3)2(aq)
Esta reação ocorre nas cavernas onde as águas muito duras se originam. O bicarbonato de cálcio não está em estado sólido, mas em uma solução aquosa, juntamente com a CA2+, Bicarbonato (HCO3-) e o íon carbonato (CO32-).
Posteriormente, ao diminuir a saturação de dióxido de carbono na água, ocorre a reação reversa, ou seja, a transformação do bicarbonato de cálcio em carbonato de cálcio:
CA (HCO3)2(aq) => CO2 (g) +h2Ou (l) +caco3 (S)
O carbonato de cálcio é pouco solúvel na água, isso faz com que sua precipitação ocorra como um sólido. A reação anterior é muito importante na formação de estalactites, estalagmites e outras espessuras nas cavernas.
Essas estruturas rochosas são formadas a partir das gotas de água que caem do teto das cavernas. O caco3 Presente nas gotas de água é cristalizado para formar as estruturas acima mencionadas.
O fato de não encontrar bicarbonato de cálcio em estado sólido impediu seu uso, encontrando poucos exemplos nesse sentido.
Estrutura de bicarbonato de cálcio
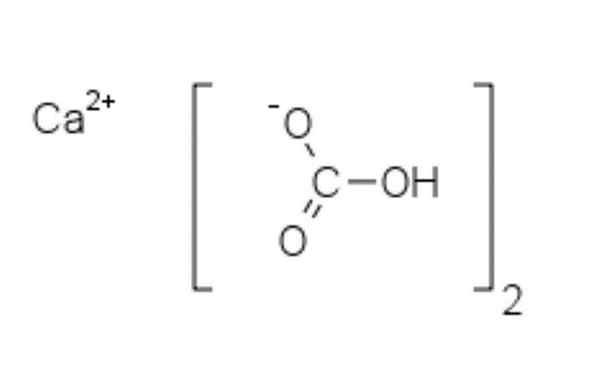 Estrutura química do bicarbonato de cálcio
Estrutura química do bicarbonato de cálcio Na imagem superior, dois ânions HCO são mostrados3- e um cátion2+ interagindo eletroestaticamente. O CA2+, De acordo com a imagem, ele deve estar localizado no meio, já que o HCO3- Eles não se repeliriam por suas cargas negativas.
A carga negativa no HCO3- Ele se muda entre dois átomos de oxigênio, por ressonância entre o grupo carbonil c = o e o link C-O-; Enquanto estiver em co32-, Isso é realocado entre os três átomos de oxigênio, pois a ligação do C-O é desprotegida e pode receber uma carga de ressonância negativa.
Pode atendê -lo: difenilaminaAs geometrias desses íons podem ser consideradas como esferas de cálcio cercadas por triângulos de carbonato plano com uma extremidade hidrogenada. Em termos de proporção de tamanho, o cálcio é notavelmente menor que os íons HCO3-.
Soluções aquosas
Bicarbonato de cálcio Você não pode formar sólidos cristalinos e realmente consiste em soluções aquosas deste sal. Neles, os íons não estão sozinhos, como na imagem, mas cercados por moléculas H2QUALQUER.
Cada íon é cercado por uma esfera de hidratação, que dependerá de metal, polaridade e estrutura das espécies dissolvidas.
O CA2+ Ele coordena com os átomos de oxigênio da água para formar um aquocomplex, CA (OH2)n2+, onde n geralmente é considerado seis; isto é, um "octaedro aquoso" em torno de cálcio.
Enquanto os ânions HCO3- Eles interagem bem, seja com pontes de hidrogênio (ou2Co-h-oh2) ou com os átomos de hidrogênio da água na direção da carga negativa (hoco2- H-OH, interação dipolo).
Essas interações entre o CA2+, HCO3- E a água é tão eficiente que eles tornam o bicarbonato de cálcio muito solúvel nesse solvente; Ao contrário do carbonato de cálcio (caco3), em que as atrações eletrostáticas entre a CA2+ e o co32- Eles são muito fortes, precipitando a solução aquosa.
Além da água, existem coléculas de co -2 ao redor, que reagem lentamente para contribuir com mais HCO3- (Dependendo dos valores de pH).
Sólido hipotético
Até agora, tamanhos de íons e cargas no bicarbonato de cálcio, nem a presença de água, explique por que não há composto sólido; isto é, cristais puros que podem ser caracterizados por cristalografia em raio x. O bicarbonato de cálcio nada mais é do que íons presentes na água a partir da qual as formações cavernosas continuam a crescer.
Sim ca2+ e o HCO3- Eles poderiam se isolar da água, evitando a seguinte reação química:
CA (HCO3)2(aq) → caco3(s) + CO2(g) + h2Ou (l)
Então eles podem ser agrupados em um sólido cristalino branco com proporções estequiométricas 2: 1 (2HCO3/1ca).
Pode atendê -lo: 30 exemplos de suspensões químicasNão há estudos sobre sua estrutura, mas pode ser comparado com o de bicarbonato de sódio (como bicarbonato de magnésio, mg (HCO3)2, nem existe como sólido), ou com o de carbonato de cálcio.
Estabilidade: bicarbonato de sódio (Nahco3) vs. bicarbonato de cálcio (CA (HCO3)2)
O bicarbonato de sódio cristaliza no sistema monoclínico e bicarbonato de cálcio nos sistemas trigonal (calcita) e ortorrombic (aragonita).
Se o NA for substituído+ para a ca2+, A rede cristalina seria desestabilizada pela maior diferença nos tamanhos; isto é, o na+ Para ser menor, ele forma um vidro mais estável com o HCO3- comparado ao CA2+.
De fato, o CA (HCO3)2(aq) precisa de água para evaporar para que seus íons possam ser agrupados em um vidro; Mas a rede cristalina disso não é forte o suficiente para fazê -lo à temperatura ambiente. Ao aquecer a água, ocorre a reação de decomposição (equação de cima).
Sendo o Ion na+ Em solução, isso formaria o vidro com o HCO3- antes de sua decomposição térmica.
A razão pela qual o bicarbonato de cálcio não se cristaliza (teoricamente), é devido à diferença de rádios iônicos ou tamanhos de seus íons, que não podem formar um cristal estável antes de sua decomposição.
Bicarbonato de cálcio (CA (HCO3)2) vs. carbonato de cálcio (caco3)
Se por outro lado, h é adicionado+ Para as estruturas cristalinas do carbonato de cálcio, eles mudariam drasticamente suas propriedades físicas. Talvez seus pontos de fusão caam significativamente, e até as morfologias dos cristais finais modificados.
Propriedades físicas e químicas
Fórmula química
CA (HCO3)2
Peso molecular
162.11 g/mol
Estado físico
Não aparece em estado sólido. É encontrado em solução aquosa e, quando o calor é aplicado para evaporar, torna -se carbonato de cálcio.
Solubilidade em água
16,1 g/100 ml a 0º C; 16,6 g/100 ml a 20º C e 18,4 g/100 ml a 100º C.
Esses valores são indicativos de uma grande afinidade das moléculas de água pelos íons do bicarbonato de cálcio, conforme explicado na seção anterior. Enquanto isso, apenas 15 mg de carbonato de cálcio se dissolvem em um litro de água, que reflete suas fortes interações eletrostáticas.
Porque bicarbonato de cálcio não pode formar um sólido, sua solubilidade não pode ser determinada experimentalmente.
No entanto, dadas as condições criadas pelo CO2 dissolvido na água que circunda o calcário, a massa de cálcio dissolvida a uma temperatura T pode ser calculada; massa que seria igual à concentração de bicarbonato de cálcio.
Pode atendê -lo: ácido benzico: síntese, transposição e usosEm diferentes temperaturas, a massa dissolvida aumenta como mostrado nos valores em 0, 20 e 100º C. Então, de acordo com esses experimentos, é determinado quanto de bicarbonato de cálcio Ele se dissolve nas proximidades do carbonato de cálcio, em um meio aquoso gaseificado com CO2.
Uma vez que o CO escapa2 Gase, o carbonato de cálcio precipitará, mas não o bicarbonato de cálcio.
Pontos de fusão e de ebulição
A rede cristalina da CA (HCO3)2 É muito mais fraco que o do caco3. Se pudesse ser obtido em estado sólido e medir a temperatura na qual derrete dentro de uma fonte, certamente um valor seria obtido bem abaixo de 899º C. Da mesma forma, o mesmo deve ser esperado para determinar o ponto de ebulição.
Ponto de combustão
Não é combustível.
Riscos
Como esse composto não existe solidamente, é improvável que represente um risco de manipular suas soluções aquosas, já que ambos os íons CA2+ Como HCO3- Eles não são prejudiciais a baixas concentrações; E, portanto, o maior risco, que seria ingerir essas soluções, só poderia ser devido a uma dose perigosa de cálcio ingerido.
Se o composto formou um sólido, mesmo talvez fisicamente diferente do caco3, Seus efeitos tóxicos não poderiam ir além do simples desconforto e ressecção após contato físico ou inalação.
Formulários
- As soluções de bicarbonato de cálcio têm sido usadas há muito tempo para lavar papéis antigos, especialmente obras de arte ou documentos historicamente importantes.
- Soluções de bicarbonato foram usadas na prevenção da osteoporose. No entanto, em um caso, efeitos colaterais como hipercalcemia, alcalose metabólica e insuficiência renal foram observados em um caso.
- O bicarbonato de cálcio é dado, ocasionalmente, intravenosa para corrigir o efeito depressivo da hipocalemia no funcionamento do coração.
- É usado para acalmar a acidez do estômago.
Referências
- Wikipedia (2018). Bicarbonato de cálcio. Retirado de: em.Wikipedia.org
- Sirah Dubois (3 de outubro de 2017). O que é bicarbonato de cálcio? Recuperado de: Livestrong.com
- Science Learning Hub (2018). Química de Carbonato. Recuperado de: ScieLarn.org.NZ
- PubChem (2018). Bicarbonato de cálcio. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov

