Características beta galactosidase, estrutura, funções
- 4626
- 254
- Terrell Stokes
O Beta galactosidase, Também chamado de β-galactosidase ou β-d-galacto-hidrolyse, é uma enzima pertencente à família de hidrolases de glicosil capaz de hidrolisando resíduos de galactosil de diferentes tipos de moléculas: polímeros, oligossacarídeos e metabólitos secundários, entre outros.
Anteriormente conhecido como "lactase", sua distribuição, bem como a dos polissacarídeos oligo e β-galactosidade que servem como substrato, são extremamente largos. É encontrado em bactérias, fungos e leveduras; Nas plantas, é comum em amêndoas, pêssegos, damasco e maçãs e, em animais, está presente em órgãos como estômago e intestino.
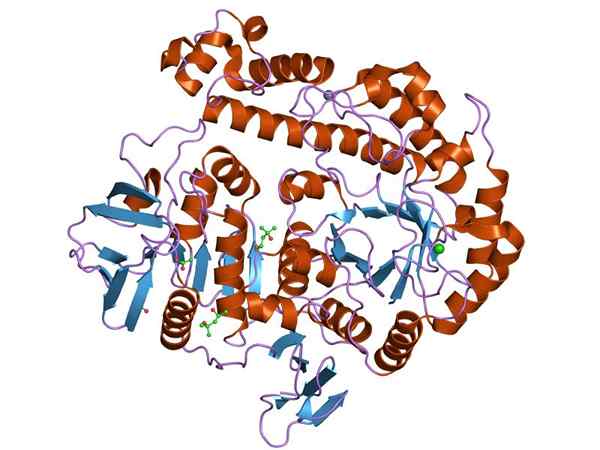
 Representação gráfica da estrutura da enzima B-galactosidase (Fonte: Jawahar Swaminathan e MSD funcionários do Instituto Europeu de Bioinformática [Domínio Público] via Wikimedia Commons)
Representação gráfica da estrutura da enzima B-galactosidase (Fonte: Jawahar Swaminathan e MSD funcionários do Instituto Europeu de Bioinformática [Domínio Público] via Wikimedia Commons) A enzima mais estudada é a do Opeon LACA de E. coli, Gen codificado Lacz, cujos estudos têm sido essenciais para entender o funcionamento da operação genética e muitos aspectos regulatórios deles.
Atualmente, pertence ao grupo enzimático melhor estudado e sua função mais conhecida é a da hidrólise dos vínculos glucosídicos da lactose. Ele cumpre funções metabólicas essenciais nos organismos que o expressam e também são usados com diferentes fins industriais.
Entre as aplicações industriais estão a remoção da lactose de produtos lácteos para pessoas intolerantes à lactose e a produção de vários compostos de galactosidade. Eles também são usados para melhorar a doçura, o gosto e a digestão de muitos produtos lácteos.
[TOC]
Caracteristicas
Além de substratos de galactosidade, como lactose, a maioria das β-galactosidases conhecidas requer íons metálicos divalentes, como magnésio e sódio. Isso foi comprovado com a descoberta de sites sindicais para esses metais em sua estrutura.
Β-galactosidas presentes na natureza têm uma grande variedade de faixas de pH para as quais podem trabalhar. As enzimas fúngicas funcionam em ambientes ácidos (2.5 a 5.4), enquanto leveduras e bactérias trabalham entre 6 e 7 unidades de pH.
Pode servir você: bactérias grama negativasbacteriano β-galactosidas
As bactérias têm grandes enzimas galato-hidrolíticas em comparação com outras galactosidas analisadas. Nesses organismos, a mesma enzima catalisa três tipos de reações enzimáticas:
- Hidrolza lactose em seus monossacarídeos constitutivos: galactose e glicose.
- Catalisa a transgastilação da lactose para a alolactose, um açúcar de dissacarídeo que participa da regulação positiva da expressão dos genes pertencentes ao Opeone LACA, Eç.
- Hidrolisa a alolactose semelhante a como é com lactose.
β-galactosidas Fungal
Os fungos têm enzimas β-galactosidase mais suscetíveis à inibição da galactose do que as enzimas pertencentes a outros organismos. No entanto, estes são termoestáveis e trabalham em faixas de pH ácidas.
O metabolismo da lactose mediado por essas enzimas em fungos é dividido em extracelular e citosólico.
Estrutura
A enzima β-galactosidase de bactérias é uma enzima tetramérica (de quatro subunidades idênticas, A-D) e cada um de seus monômeros tem mais de 1.000 resíduos de aminoácidos, o que significa um peso molecular de mais de 100 kDa para cada e mais de 400 kDa para a proteína complexa.
Nas plantas, pelo contrário, a enzima é consideravelmente menor e pode ser comumente encontrada como um dímero de subunidades idênticas.
Os domínios de cada monômero são distinguidos com os números de 1 a 5. O domínio 3 possui uma estrutura de barril α/β “TIM” e tem o local ativo na extremidade C-terminal do barril.
Pode atendê -lo: organogênese animal e vegetal e suas característicasPresume -se que os locais ativos do complexo enzimático sejam compartilhados entre monômeros, portanto essa enzima é biologicamente ativa apenas quando é complexa como um tetrâmetro.
Seu site ativo tem a capacidade de se juntar a D-glucosa e D-galactose, os dois monossacarídeos que compõem lactose. É particularmente específico para a D-galactose, mas não é tanto para a glicose, então a enzima pode agir em outros galactosídeos.
Funções
Em animais
No intestino dos seres humanos, a principal função dessa enzima tem a ver com a absorção de lactose ingerida com comida, pois está localizada na face luminal da membrana plasmática das células intestinais na forma de uma forma de escova.
Além disso, foi demonstrado que as isoformas lisossômicas dessa enzima participam da degradação de muitos glicolipídios, mucopolissacarídeos e glicoproteínas de galactosidade, que possuem vários propósitos em diferentes rotas celulares.
Em plantas
As plantas têm enzimas β-galactosidase nas folhas e sementes. Estes cumprem funções importantes no catabolismo dos galactolipídios, que são característicos de algas e plantas em geral.
Nesses organismos, a β-galactosidase participa dos processos de crescimento das plantas, maturação de frutas e, nas plantas superiores, esta é a única enzima conhecida capaz de hidrolisando resíduos galactosil dos polissacarídeos da galacosidade da parede celular.
Na indústria e pesquisa
Na indústria de alimentos relacionada a produtos lácteos, a enzima β-galactosidase é usada para catalisar a hidrólise da lactose presente em produtos lácteos, responsável por muitos dos defeitos relacionados ao armazenamento desses produtos.
A hidrólise desse açúcar procura evitar a sedimentação de partículas, a cristalização de sobremesas de laticínios congelados e a presença de texturas "arenosas" na maioria dos derivados comerciais de leite.
Pode servir você: cadeia alimentar da Terra: links e exemploA β-galactosidase usada é industrialmente obtida, geralmente, do fungo Aspergillus sp., Embora a enzima produzida por levedura Kluyveromyces lactis Também é amplamente usado.
A atividade da β-galactosidase, que se traduz em termos científicos como "fermentação por lactose", é rotineiramente testada para a identificação de enterobactérias gram-negativas presentes em diferentes tipos de amostras.
Além disso, em termos médicos, é usado para a produção de laticínios sem lactose e para a formulação de comprimidos usados por pessoas intolerantes à lactose para digerir leite e seus derivados (iogurte, queijo, sorvete, manteiga, cremes, etc.).
É usado como "biossensores" ou "biomarcador" com diversidade de propósitos, de imunoensaios e análise toxicológica até a análise da expressão gênica e diagnóstico de patologias graças à imobilização química dessa enzima em apoios especiais em apoios especiais.
Referências
- Henrissat, b., & Daviest, G. (1997). Classificação estrutural e baseada em sequência de hidrolas de glicosídeo. Biologia atual, 7, 637-644.
- Huber, r. (2001). Beta (b) -galactosidase. Academic Press, 212-214.
- Husain, q. (2010). β galactosidaese e suas aplicações em potencial: uma revisão. Revisões críticas em biotecnologia, 30, 41-62.
- Juiz, d. H., Matthews, b. C., & Huber, r. E. (2012). Lacz b-galactosidase: estrutura e função de uma enzima de importância biológica histórica e molecular. Proteína científica, vinte e um, 1792-1807.
- Lee, b. E., Han, J. PARA., IM, J. S., Morrone, a., Johung, k., Goodwin, c.,... Hwang, e. S. (2006). A β -galactosidase entre senescência é lisossômica β -Gastosidase. Célula envelhecida, 5, 187-195.
- Matthews, b. C. (2005). A estrutura de E. β-galactosidase coli. C. R. Biologias, 328, 549-556.
- McCarter, J. D., & Withers, S. G. (1994). Mecanismos de hidrólise enzimática de glicosídeo. Opinião atual em biologia estrutural, 4, 885-892.
- Richmond, m., Gray, j., & Stine, C. (1981). Beta-galactosidase: revisão de recentes relacionadas à aplicação tecnológica, preocupações nutricionais e imobilização. J Dairy Sci, 64, 1759-1771.
- Wallenfels, k., & Weil, r. (1972). B-galactosidase.
- « Características mínimas do método de custo, vantagens, desvantagens
- Método húngaro o que consiste, exemplo »

