Balanceamento de equações químicas
- 2010
- 483
- Conrad Schmidt
Qual é o equilíbrio de equações químicas?
O equilíbrio das equações químicas é uma operação matemática que é realizada para manter a lei da conservação da matéria nas reações. A matéria não é criada ou destruída. Portanto, o número de átomos antes e depois de uma reação química deve ser a mesma, tanto nos reagentes quanto nos produtos.
Para equilibrar uma equação química, você precisa contar os átomos antes e depois da flecha. Se os números coincidem, significa que a reação é equilibrada. Caso contrário, será necessário corresponder a esses números modificando os coeficientes estequiométricos por tentativa e erro, sendo este o método mais simples e intuitivo para equilíbrio.
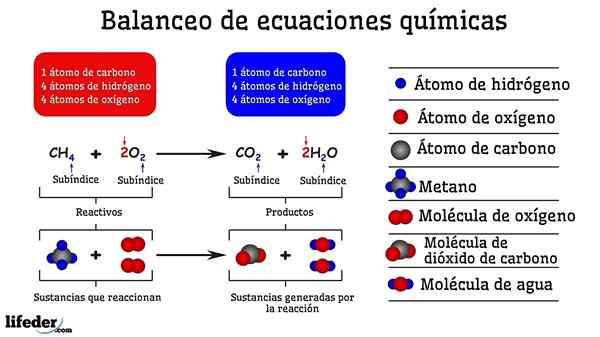
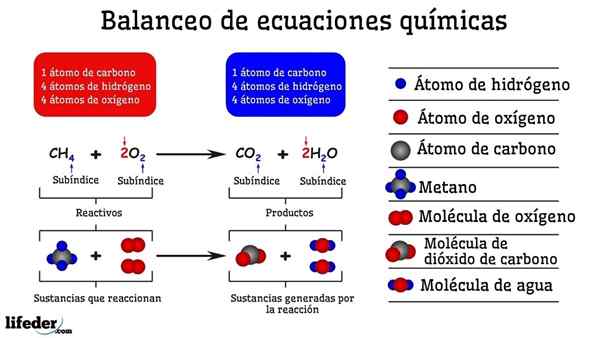 Exemplo de balanceamento químico da reação entre metano e duas moléculas de oxigênio
Exemplo de balanceamento químico da reação entre metano e duas moléculas de oxigênio Quando é equilibrado por tentativa e erro, é como se fossem removidos ou adicionados átomos em um dos dois lados do subbaja. Até que o subbaja não seja suspenso horizontalmente, a equação química não será completamente equilibrada. Não pode haver mais (criar matéria) ou menos átomos (destruir a matéria) de qualquer lado.
Exemplos de equilíbrio fácil de equações
Nos exemplos a seguir, você verá equações químicas equilibradas ou fáceis de equilibrar. Todos devem ter em comum que o número de átomos, para cada um dos elementos, seja o mesmo antes e depois da seta quando a equação química for equilibrada.
Oxidação de mercúrio
2hg +o2 → Hg2QUALQUER2
Temos dois elementos: mercúrio (hg) e oxigênio (o). Expressamos o número de seus átomos antes (reagentes) e depois (produtos) da seta:
HG: 2 (esquerda) - 2 (direita)
Pode servir a você: fração molar: como é calculado, exemplos, exercíciosO: 2 (esquerda) - 2 (direita)
A equação é equilibrada porque hg átomos e ou são os mesmos nos dois lados da seta.
Combustão de hidrogênio
H2 + QUALQUER2 → h2QUALQUER
Temos dois elementos novamente: hidrogênio (h) e oxigênio (O). Repetindo a etapa anterior:
H: 2 - 2
O: 2 - 1
No lado esquerdo, há um oxigênio mais do que na direita. Portanto, devemos adicionar outro oxigênio certo. Para fazer isso, modificamos os coeficientes estequiométricos, que são os números que acompanham e precedem as fórmulas. Se colocarmos um 2 na frente de H2Ou vai nos dar:
H2 + QUALQUER2 → 2h2QUALQUER
H: 2 - 4
O: 2 - 2
O oxigênio é equilibrado. Mas não hidrogênios. Você tem que adicionar dois hidrogênios agora à esquerda:
2h2 + QUALQUER2 → 2h2QUALQUER
H: 4 - 4
O: 2 - 2
E a equação é finalmente equilibrada: o mesmo número de H e ou antes e depois da flecha.
Observe que coeficientes estequiométricos (2 para H2 e 1 para o O2) multiplique os subscritos das fórmulas. Essa multiplicação nos dará o número total de átomos para um elemento específico.
Redução de magnésio
Mg (não3)2 + 2li → mg +2linO3
Avaliamos os números de átomos para cada elemento:
Mg: 1 - 1
Li: 2 - 2
N: 2 - 2
O: 6 - 6
A equação química já está equilibrada e não há necessidade de equilibrar.
Exercícios resolvidos
Antes de prosseguir para equilibrar qualquer equação, é sempre necessário confirmar se não está mais equilibrada. Dito isto, prosseguimos com o seguinte exercício:
Exercício 1
Equilibrado ou não?
Fé2QUALQUER3 + H2O → Fé (OH)3
Temos três elementos: ferro (fé), hidrogênio e oxigênio. Uma sugestão no momento das equações de equilíbrio é começar a contar os números de átomos do elemento menos abundante na equação; que geralmente é diferente de H e O. Assim, primeiro contamos os átomos da fé:
Pode atendê -lo: metil salicilatoFé: 2 - 1
Subscrito 3 de (OH)3 Não multiplique a fé à esquerda. Para H e O temos:
H: 2 - 3
O: 4 - 3
Todos os elementos estão desequilibrados.
Oscilante
Antes mesmo de equilíbrio H e O, devemos equilibrar os átomos da fé: o elemento menos abundante, pois não há 3 fé, ao contrário de 5 h e 7 ou 7 ou 7. Você tem que acrescentar, então, uma fé à direita:
Fé: 2 - 2
O que é igual a colocar um 2 como coeficiente estequiométrico na frente da fé (OH)3. A equação permanecerá:
Fé2QUALQUER3 + H2O → 2FE (OH)3
Fé: 2 - 2
H: 2 - 6
O: 4 - 6
Mas o H e O ou continue desequilibrado. Um H2Ou contribuir 2 h e não temos 4 h. Portanto, adicionaremos mais dois h2Ou para nós termos três h2QUALQUER:
Fé2QUALQUER3 + 3h2O → 2FE (OH)3
E avaliamos novamente:
Fé: 2 - 2
H: 6 - 6
O: 6 - 6
Observe como eles os estavam equilibrando quando uma vez equilibramos o H. A equação é finalmente equilibrada.
Exercício 2
Equilibrado ou não?
CH4 + QUALQUER2 → co2 + H2QUALQUER
Avaliamos o número de átomos para todos os elementos atuais:
C: 1 - 1
H: 4 - 2
O: 2 - 3
O carbono é equilibrado, mas o mesmo não acontece com hidrogênio e oxigênio. A equação está desequilibrada.
Oscilante
Como o C é equilibrado, não queremos modificar os coeficientes estequiométricos de CH4 ou co2. Pelo menos não em princípio.
Nós concentramos nossa atenção em H e O, especialmente em H. Porque? Porque ver a equação é mais fácil equilibrar h antes ou. Precisamos adicionar 2 h à direita, colocando um coeficiente 2 na frente de H2QUALQUER:
CH4 + QUALQUER2 → co2 + 2h2QUALQUER
C: 1 - 1
H: 4 - 4
O: 2 - 4
C e H são equilibrados. Ficamos 2 ou deixados. Se cada um ou2 contribui 2 ou, adicionaremos um ou2 extra para que tenham 4 ou à esquerda. É o mesmo que colocar um coeficiente 2 na frente do O2:
Pode atendê -lo: óxido de enxofreCH4 + 22 → co2 + 2h2QUALQUER
C: 1 - 1
H: 4 - 4
O: 4 - 4
E a equação é finalmente equilibrada.
Exercício 3
Equilibrado ou não?
N2 + H2 → NH3
Avaliamos para nossos dois elementos n e h:
N: 2 - 1
H: 2 - 3
A equação não é equilibrada.
Oscilante
Começamos equilibrar o n, o elemento diferente de H. Não temos um direito, e como todo NH3 contribui 1 n, devemos adicionar outro NH3 Ter 2 n:
N2 + H2 → 2NH3
N: 2 - 2
H: 2 - 6
E agora estamos perdendo a esquerda. Se cada h2 Contribua com 2 h para a equação, então devemos adicionar outros dois para que haja 6 h. É o mesmo que colocar um coeficiente estequiométrico 3 na frente de H2:
N2 + 3h2 → 2NH3
N: 2 - 2
H: 6 - 6
E a equação química é finalmente equilibrada.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Química Librettexts. (23 de novembro de 2020). Como escrever equações químicas equilibradas. Recuperado de: química.Librettexts.org
- Wikipedia. (2020). Equação química. Recuperado de: em.Wikipedia.org
- Princípios da química. (s.F.). Escrever e equilibrar equações químicas. [PDF]. Recuperado de: web.Ung.Edu
- PHET. (s.F.). Balanceamento de equações químicas. Recuperado de: PHET.Colorado.Edu
- Armando Marín b. (s.F.). Química geral: balanceamento de equações. [PDF]. Recuperado de: DePa.Fquim.Unam.mx

