Estrutura de sódio azida (NAN3), propriedades, usos, riscos

- 3357
- 962
- Terrell Stokes
O Azida de sódio É um sólido inorgânico cristalino formado pelo íon de sódio na+ E o Azida n íon3-. Sua fórmula química é NAN3. O composto nan3 É o sal de sódio do ácido hidrazóico HN3. A nan3 É um sólido cristalino de incolor para branco.
Embora seja um composto muito tóxico, um de seus empregos mais difundidos está nos airbags que são infectados instantaneamente durante acidentes de veículo. Também serve para inflar rapidamente os slides de emergência da aeronave. No entanto, atualmente seu uso está sendo muito questionado em ambos os casos por sua toxicidade.
 Nan Nan Azid3 sólido. И.С. [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons.
Nan Nan Azid3 sólido. И.С. [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons. É usado em laboratórios de pesquisa química para sintetizar vários tipos de compostos e em laboratórios bioquímicos para estudos com bactérias, fungos ou células de mamíferos ou humanas.
Em alguns laboratórios, é usado para esterilizar materiais ou equipamentos, mas certos tipos de microorganismos resistem à sua ação biocida.
Também tem sido usado na agricultura para eliminar os parasitas do solo ou na indústria de madeira para impedir que a madeira de pinheiro manchasse com fungos.
[TOC]
Estrutura
O sódio azida nan3 É formado por um cátion de sódio+ e um ânion azid n3-.
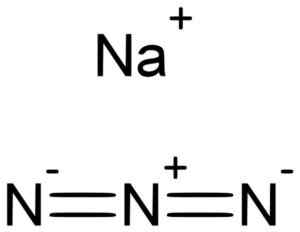 O sódio azida é formado pelo sódio na+ E o Azida n íon3-. Lukáš mižoch [domínio público]. Fonte: Wikimedia Commons.
O sódio azida é formado pelo sódio na+ E o Azida n íon3-. Lukáš mižoch [domínio público]. Fonte: Wikimedia Commons. O Azida n íon3- Consiste em 3 átomos de nitrogênio (n) unidos um pelo outro por ligações covalentes que podem ser simples, duplas ou triplas, pois os elétrons são compartilhados entre os três.
Este ânion tem uma estrutura linear, ou seja, os três átomos de nitrogênio dispostos em uma linha reta. Além disso, a estrutura é simétrica.
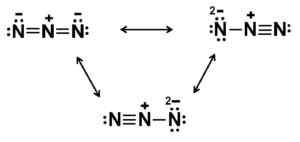 Possíveis estruturas de Lewis do ânion Azida. Autor: Marilú Stea.
Possíveis estruturas de Lewis do ânion Azida. Autor: Marilú Stea. Nomenclatura
- Azida de sódio
- Azida de sódio
Propriedades
Estado físico
Sólido cristalino Solid Color to White. Cristais hexagonais.
Peso molecular
65,01 g/mol
Ponto de fusão
Se decompõe a 275 ºC.
Densidade
1.846 g/cm3 A 20 ºC
Solubilidade
É muito solúvel em água: 41,7 g/100 ml a 17 ºC. É levemente solúvel em etanol e insolúvel em éter etílico.
Constantes de dissociação
Tem um PKb 9.3. Soluções aquosas contêm NH3, que escapa rapidamente do meio ambiente a 37 ºC.
Propriedades quimicas
A nan3 É muito corrosivo em relação ao alumínio e moderadamente para o cobre e o chumbo.
Pode atendê -lo: valências de nitrogênioDe acordo com uma certa fonte consultada, o sódio azid não é explosivo. Decompõe -se suavemente e completamente quando é aquecido a 300 ºC ou mais, formando metal de sódio e nitrogênio gasoso n2.
2 nan3 → 2 Na + 3 n2↑
É um agente de nitroração, isso significa que serve ao nitrogênio ou adicionar nitrogênio a outros compostos químicos ou à superfície de materiais como aço.
É estável em água neutra ou alcalina na ausência de luz. Se decompõe através da radiação solar.
Propriedades bioquímicas
A azid de sódio inibe uma enzima chamada citocromo oxidase, que é encontrada nas mitocôndrias das células e está significativamente envolvida na respiração e geração de energia neste.
Sua ação impede a geração de ATP de um composto chave nas atividades celulares e as células se deteriora ou danos.
Se for ingerido, inalado ou contato com a azid de sódio, é muito tóxico e pode se tornar letal.
Obtenção
NH amônia está reagindo3 Com Metal Sodio Na a 350 ºC em um recipiente de aço fechado, obtendo amida do NANH de sódio2.
NANH de sódio2 Está reagindo com monóxido de dyitrogênio n2Ou a 230 ° C em um reator de níquel e, portanto, uma mistura de nan de sódio é formada3, Hidróxido de sódio Naoh e amônia NH3.
2 NANH2 + N2O → nan3 + Naoh + NH3
Também pode ser obtido reagindo amida de sódio com nano nitrato de sódio3 a 175 ºC:
3 NANH2 + Irmão mais velho3 → nan3 + 3 Naoh + NH3
Para purificar a azid, a água é adicionada à mistura, os cristais da azid são lavados e depois a água evapora. O material cristalino que permanece é a azid de nan de sódio3 que então seca a 110 ºC.
Formulários
Em veículos a motor e aeronaves
A azid de sódio tem sido amplamente utilizada na indústria automobilística como gerador de nitrogênio para inflar rapidamente airbags (inglês Airbags) Segurança de folhetos de carro e caminhões quando ocorre um impacto.
Também tem sido usado em slides infláveis que servem para escapar rapidamente do interior dos aviões que chegaram em situações de emergência.
Nos dois casos, o mecanismo envolve a ação de uma faísca para produzir a reação imediata entre a azid de sódio e certos compostos, gerando gases de nitrogênio n2 e óxido de sódio na2QUALQUER.
Pode atendê -lo: reação de substituição duplaEste aplicativo requer liberação instantânea de um gás frio e não técnico, portanto o nitrogênio é o gás mais apropriado.
 Sacolas de segurança que já foram usadas em veículos. Autor: Marcel Langthim. Fonte: Pixabay.
Sacolas de segurança que já foram usadas em veículos. Autor: Marcel Langthim. Fonte: Pixabay. No entanto, esse uso está diminuindo devido à toxicidade da azid de sódio e, em vez disso, são usados menos compostos tóxicos.
Na indústria química
É usado como retardador na fabricação de borracha para esponjas, para impedir a coagulação do látex de alongamento ou butadieno quando são armazenados em contato com metais e para decompor nitritos na presença de nitratos.
Na agricultura
Foi usado na agricultura: como biocida e fumigante, também é nematicida, ou seja, é aplicada em solos para eliminar nematóides, que são parasitas que atacam algumas culturas.
 Danos causados por nematóides na raiz de uma planta. Autor: Redwolf. [http: // www.Ars-grin.Gov/Ars/Soatlantic/FP/Stpp/Burelle/Burelle.HTML] Fonte: Wikimedia Commons.
Danos causados por nematóides na raiz de uma planta. Autor: Redwolf. [http: // www.Ars-grin.Gov/Ars/Soatlantic/FP/Stpp/Burelle/Burelle.HTML] Fonte: Wikimedia Commons. Também funcionou como herbicida e para evitar frutas podres.
Recentemente Nan3 Foi usado na preparação de quiabo ou sementes de quimbombó para observar sua resistência às condições de água d'água.
As sementes às quais Nan foi aplicada anteriormente3 Eles geraram mudas que retiraram melhor as condições de inundação do que as irracionais, melhoraram a altura das plantas, aumentaram o número de folhas e aumentaram a quantidade de raízes, mesmo com o excesso de água.
Na preparação de outros compostos químicos
É usado como um reagente químico na síntese de compostos orgânicos, por exemplo, para preparar muitos azidores orgânicos, como os azidas de grupo alquil terciário, que são importantes na síntese química.
Serve para preparar o ácido hidrazóico (hn3) e sódio puro (NA).
Na indústria explosiva
O sódio azida nan3 É um intermediário na fabricação explosiva, como é usado para a preparação do chumbo azid3)2. Este último é um composto que explode quando derrotado fortemente, por isso é usado na construção de detonação de dispositivos.
 O sódio azida nan3 É usado para fabricar o chumbo PB (n3)2 Composto que faz parte dos dispositivos para gerar explosões. Autor: OpenClipart-Vectors. Fonte: Pixabay.
O sódio azida nan3 É usado para fabricar o chumbo PB (n3)2 Composto que faz parte dos dispositivos para gerar explosões. Autor: OpenClipart-Vectors. Fonte: Pixabay. Em laboratórios bioquímicos
A azid de sódio é usada quando o equipamento de laboratório estéril é necessário, pois é capaz de destruir diferentes tipos de microorganismos.
Pode atendê -lo: ácido pituitado (H3PO2): Propriedades, usos e reagentesÉ um agente biocida. No entanto, algumas fontes indicam que alguns tipos de bactérias são resistentes à sua ação.
Isso é conseguido bloqueando o local de ligação ao oxigênio no citocromo oxidase que é uma enzima envolvida no processo de produção de energia de alguns microorganismos.
É usado em contadores de sangue automáticos, também na seleção diferencial de bactérias e para preservar as soluções de reagentes de laboratório porque impede o crescimento de certos microorganismos nestes.
Em vários usos
O sódio Azida serve na indústria de madeira para evitar o crescimento de manchas de fungos marrons em madeira de pinheiro.
Também tem sido usado na indústria de cerveja japonesa para evitar o desenvolvimento de um fungo que escurece que bebe.
Riscos
A azid de sódio é um composto tóxico que inibe uma enzima importante para respirar e vida das células humanas e animais. Verificou -se que isso pode afetar seriamente as células do tecido celular do vaso sanguíneo cerebral.
Seu efeito imediato após a ingestão, a inalação ou o contato da pele é diminuir a pressão arterial perigosamente, o que pode levar à morte. Portanto, deve ser manipulado com grande cautela.
Existem fontes de informação que atraem atenção para os airbags de veículos que são destruídos por motivos de lixo.
Nesses casos, as pessoas que não conhecem o perigo podem acessar depósitos de nan3, Este é um composto muito tóxico. Além disso, existe o perigo de contaminação com NAN3 solo e águas.
Da mesma forma, durante acidentes, colisões ou incêndios em veículos, as pessoas podem ser expostas a NAN3 E isso pode ser subestimado ou desconhecido pela equipe médica que compareceu à emergência.
Atenção à exibição de pessoal de laboratório que o usa também foi chamado.
Referências
- Vwioko, e.D. et al. (2019). Azing de azida de sódio aumenta a tolerância ao estresse de água no quiabo (Abelmoschus esculentus). Agronomia 2019, 9, 670. MDPI se recuperou.com.
- Kho, d.T. et al. (2017). Morte de células endoteliais da barreira do cérebro sanguíneo para azida de sódio e seus produtos gasosos. Biossensores 2017, 7, 41. MDPI se recuperou.com.
- OU.S. Biblioteca Nacional de Medicina. (2019). Azida de sódio. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov.
- Talavera, m. et al. (2019). Gerenciamento de nematóides nos campos de morango do sul da Espanha. Agronomia 2019, 9, 252. MDPI se recuperou.com.
- Okano, t. et al. (novecentos e noventa e cinco). Mecanismo de descolamento celular de superfícies poliméricas moduladas por temperatura e hidrofílico-hidrofóbica. Nos biomateriais: Silver Jubileu Compêndio. Recuperado de cientedirect.com.
- Enciclopédia de química industrial de Ullmann. (1990). QUINTA EDIÇÃO. Volume A22. Vch verlagsgellschaft mbh.
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- Chang, s. e Lamm, S.H. (2003). Efeitos da saúde humana da exposição à azida de sódio: uma revisão e análise de literatura. Int J Toxicol 2003, 22 (3): 175-86. NCBI se recuperou.Nlm.NIH.Gov.

