História, estrutura, propriedades, usos e riscos antimônicos

- 985
- 218
- Lonnie MacGyver
Ele antimônio É um metalóide prateado e brilhante e com um certo tom azul. Seu sólido também é caracterizado por ser muito quebradiço e de textura escamosa. Pertence ao grupo 15 da tabela periódica, liderada por nitrogênio. Após o bismuto (e o Moscowium), é o elemento mais pesado do grupo.
É representado pelo símbolo químico sb. Na natureza, é encontrado principalmente em minerais de stabit e ullmannite, cujas fórmulas químicas são SB2S3 e nisbs, respectivamente. Sua alta tendência a formar sulfetos em vez de óxidos é porque é quimicamente macio.
 Antimônio cristalino. Fonte: Melhores Sci-FATCs [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]
Antimônio cristalino. Fonte: Melhores Sci-FATCs [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] Por outro lado, o antimônio também é fisicamente macio, apresentando uma dureza de 3 na escala MOHS. É estável à temperatura ambiente e não reage com oxigênio do ar. Mas quando aquecido na presença de oxigênio, ele forma o trióxido de antimônio, sb2QUALQUER3.
Também é resistente à ação de ácidos fracos; Mas o quente é atacado por ácidos nítricos e clorídrico.
O antimônio tem inúmeras aplicações, entre elas é usado em ligas com chumbo e estanho, na fabricação de baterias para veículos, materiais de baixo atrito, etc.
Este metalóide tem o raro de propriedade de aumentar o volume quando solidificado, permitindo que suas ligas ocupem completamente o espaço usado para moldar o instrumento que se desejava fabricar.
[TOC]
História da sua descoberta
Antes de Cristo
Há evidências de que de 3100 a.C, o sulfeto de antimônio foi usado como cosmético no Egito. Na Mesopotâmia, o Iraque atual, restos de um vaso e outro artefato foram encontrados que supostamente data entre os 3000 e 2200 anos para.C, no qual foi usado em sua elaboração de antimônio.
Introdução do termo
Roman Erúdito Plinio El Viejo (23-79 D.c) descreveram o uso de antimônio, que ele chamou de Estibio, na elaboração de sete medicamentos em seu tratado de história natural. Alquimista Abu Mussa Jahir Ibn Hayyan (721-815) é atribuído à introdução do termo antimônio para nomear o elemento.
Ele usou a seguinte etimologia: 'Anti' como sinônimo de negação e 'mono' apenas para. Então ele queria enfatizar que o antimônio não estava sozinho na natureza. Já se sabe que faz parte de minerais de enxofre, que como outros elementos.
Obtenção
Acredita -se que o grego naturista Pedanius Discorides obtenha antimônio puro, aquecendo o sulfeto de antimônio em uma corrente de ar. O Vannocio Biringucio, metalúrgico italiano, no Livro dos Pirotecnia (1540), faz uma descrição de um método para isolar o antimônio.
O químico alemão Andreas Libavius (1615), através do uso de uma mistura fundida de ferro, sulfeto de antimônio, sal e potássio, alcançou a produção de um antimônio cristalino.
O primeiro relatório detalhado sobre o antimônio foi feito em 1707 pelo químico francês Nicolas Lemery (1645-1715), em seu livro tratado no antimônio.
Pode servir a você: cloreto de cobre (i) (CUCL): estrutura, propriedades, usosEstrutura antimônia
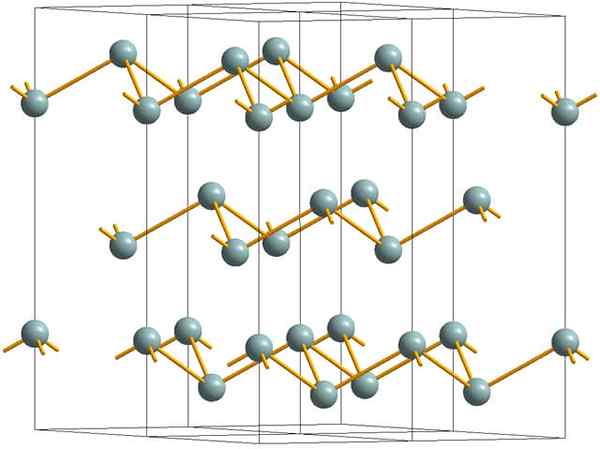 Camadas enrugadas que compõem a estrutura cristalina de antimônio metálico ou prateado. Fonte: MaterialScientist [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]
Camadas enrugadas que compõem a estrutura cristalina de antimônio metálico ou prateado. Fonte: MaterialScientist [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] A imagem superior mostra a estrutura das camadas enrugadas adotadas por átomos de arsênico. No entanto, antimônio acinzentado, mais conhecido como antimônio metálico, também adota essa estrutura. Dizem que está "enrugado" porque existem átomos SB que aumentam e caem do avião composto pela camada.
Essas camadas, embora sejam responsáveis pelos fótons que interagem com ela para brilhar os brilhos de prata, tornando o antimônio como um metal, a verdade é que as forças que as unem são fracas; Daqui para os aparentes fragmentos de metal de SB, podem ser facilmente mostrados e são quebradiços ou tênis.
Além disso, os átomos de SB em camadas enrugadas não são suficientes para agrupar seus orbitais atômicos e, assim, criar uma banda que permita a condução elétrica.
Vendo uma esfera acinzentada individualmente, você pode ver que ela tem três links SB-SB. De um plano superior, o SB pode ser visto no centro de um triângulo, com três SB localizados em seus vértices. No entanto, o triângulo não é plano e tem dois níveis ou pisos.
A reprodução lateral de tais triângulos e seus links estabelece camadas enrugadas, que são alinhadas para formar cristais romboébicos.
Alotropia
A estrutura recém -descrita corresponde ao antimônio acinzentado, o mais estável de seus quatro Apotropes. Os outros três muitos (pretos, amarelos e explosivos) são metaestáveis; isto é, eles podem existir em condições muito rigorosas.
Não há muita informação sobre suas estruturas. Sabe -se, no entanto, que o antimônio negro é amorfo, de modo que sua estrutura é confusa e complexa.
O antimônio amarelo está estável abaixo de -90ºC, se comporta como um elemento não -metálico e pode ser conjeturado que consiste em pequenos aglomerados SB4 (semelhante ao fósforo); Quando aquecido, ele se transforma no Alotrope negro.
E com relação ao antimônio explosivo, consiste em um tanque gelatinoso formado no cátodo durante a eletrólise de uma solução aquosa de um halogeneto antimônio.
Ao menor lixo forte.
Propriedades
Peso atômico
121,76 g/mol.
Número atômico
51.
Configuração eletronica
[KR] 4D105s25 p3.
Estados de oxidação
-3, -2, -1, +1, +2, +3, +4, +5.
Descrição física
Superfície brilhante de prata, quebradiça e escamosa, com um tom azul. Também pode aparecer como uma poeira preta.
Ponto de fusão
630.63 ºC.
Ponto de ebulição
1.635 ºC.
Densidade
-6.697 g/cm3 à temperatura ambiente.
-6,53 g/cm3 No estado líquido, temperatura igual ou superior ao ponto de fusão.
Calor de fusão
19,79 KJ/mol.
Calor de vaporização
193.43 KJ/mol.
Pode atendê -lo: sulfeto de cobre: estrutura, propriedades, usosCapacidade calórica molar
25.23 J/mol.K
Eletro-negatividade
2.05 (Escala Pauling).
Rádio atômico
140 pm.
Dureza
É um elemento suave, com uma dureza de 3 na escala MOHS e pode ser arranhada por vidro.
Estabilidade
É estável à temperatura ambiente, não experimentando oxidação. Também é resistente ao ataque ácido.
Isótopos
Tem dois isótopos estáveis: 121Sb e 123Sb. Além disso, existem 35 isótopos radioativos. O isótopo radioativo 125SB é aquele com a maior meia -vida: 2,75 anos. Em geral, os isótopos radioativos emitem radiação β+ e β-.
Condutividade elétrica e térmica
Antimônio é um mau condutor de calor e eletricidade.
Reatividade química
Não pode deslocar o hidrogênio de ácidos diluídos. Formulário de complexo iônico com ácidos orgânicos e inorgânicos. O antimônio metálico não reage com o ar, mas é rapidamente convertido em óxido no ar molhado.
Halogênios e sulfetos oxidam facilmente o antimônio, se o processo ocorrer em altas temperaturas.
Formulários
Ligas
O antimônio é usado em liga com chumbo para a elaboração de placas para baterias de carro, melhorando a resistência das placas, bem como as características das cargas.
A liga de chumbo e lata tem sido usada para melhorar as características das soldas, bem como as das balas e cartuchos do traçador. Também é usado em ligas para revestimento de cabo elétrico.
O antimônio é usado em ligas de antifricção, na preparação de ligas de casca e endurecimento com baixo teor de estanho na fabricação de órgãos e outros instrumentos musicais.
Apresenta a característica, compartilhada com a água, de aumentar o volume quando condensado; Assim, o antimônio presente em ligas com chumbo e lata preenche todos os espaços dos moldes, melhorando a definição das estruturas feitas com essas ligas.
Retardante de fogo
O trióxido de antimônio é usado para a elaboração de compostos iniphados, sempre em combinação com retardadores de fogo halogenados, bromuros e cloreto.
Os retardadores de incêndio podem reagir com oxigênio e átomos radicais oh, que inibe o fogo. Estes ignifados são usados em roupas para crianças, brinquedos, aeronaves e assentos de carro.
Eles também são adicionados em resinas de poliéster e em compostos de fibra de vidro para itens usados, como a capa de motores de aeronaves leves.
Os compostos antimônicos usados como retardadores de fogo incluem: oxicloreto de antimônio, SBOCL; Pentóxido de antimônio, SBO5; Tricloreto de Antimônio, SBCL3; e Trioxide Antimony, SBO3.
Campo eletrônico
É usado na fabricação de semicondutores, diodos, detectores de infravermelho médio e na elaboração de transitores. O antimônio de alta pureza, usado na tecnologia de semicondutores, é obtido pela redução de compostos antimônicos com hidrogênio.
Pode atendê -lo: fatores que afetam a solubilidadeMedicina e veterinário
Os compostos antimônicos têm sido usados na medicina desde os tempos antigos, como Eméticos e Antiprotozoa. O potássio Tartrato (tártaro estético) foi usado como um anti -quisossomal por um longo tempo; também usado como expectorante, diaforético e emético.
Os sais antimônicos também foram utilizados no condicionamento da pele de animais ruminantes; como aniomalina, lítio e tiomalato de antimônio.
Antimônio de Meglumina é um medicamento usado no tratamento da leishmaniose em destaque externo de animais domésticos. Embora os benefícios terapêuticos fossem escassos.
Pigmentos e pinturas
Os compostos antimônicos são usados na elaboração de tintas e opacificadores em esmaltes. Eles também são usados em Bermellón, pigmentos amarelos e laranja, que são produtos de oxidação lenta de sulfetos de antimônio.
Alguns de seus sais orgânicos (tartratos) são usados na indústria têxtil para ajudar no link de certos corantes.
O sulfeto de antimônio foi usado no Egito antigo como cosmético no escurecimento dos olhos.
Outros usos
Alguns sais de antimônio são usados como agentes de revestimento para eliminar bolhas microscópicas formadas nas telas de televisão. Os íons antimônicos interagem com o oxigênio, eliminando sua tendência a formar bolhas.
O sulfeto de antimônio (III) é usado nas cabeças de algumas correspondências de segurança. O sulfeto de antimônio também é usado na estabilização do coeficiente de atrito dos materiais usados nas pastilhas de freio do carro.
O isótopo 124SB, juntamente com o berílio, é usado como fonte de nêutrons, com uma média energética de 24 keV. Além disso, o antimônio é usado como catalisador na produção de plásticos.
Riscos
É um elemento quebradiço, para que um pó poluente do ambiente possa ocorrer durante a manipulação. Em trabalhadores expostos à poeira antimônia, dermatite, renite, inflamação do trato respiratório alto e conjuntivite foi observado.
A pneumoconiose foi descrita, às vezes combinada com mudanças pulmonares obstrutivas, após exposições prolongadas.
O trióxido de antimônio pode causar danos ao funcionamento do coração que podem ser mortais.
Em pessoas expostas a esse elemento, foi observada a presença de infecções pustulares da pele, de natureza transitória.
A ingestão contínua de baixa dose deste metal pode causar vômitos de diarréia e úlceras estomacais. Além disso, a concentração máxima tolerável no ar é de 0,5 mg/m3.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Manny. (11 de março de 2009). Antimônio amarelo e antimônio explosivo. Recuperado de: AntimonyProperties.Blogspot.com
- Prof. Ernst Cohen e J. C. Van den Bosch. (1914). A alotropia de antimônio. Procedimentos Royal Acad. Amsterdã. Vol. Xvii.
- Wikipedia. (2019). Antimônio. Recuperado de: em.Wikipedia.org
- Advameg, inc. (2019). Antimônio. Recuperado de: química explaada.com
- Sabre Mc'Oneal. (15 de setembro de 2018). Química: Propriedades e aplicação de SB-Antimony. Recuperado de: médio.com
- « História da biogeografia, quais estudos e exemplos de pesquisa
- Poluição auditiva Causas, consequências, soluções »

