Anidrides ácidos Como são formados, aplicações e exemplos

- 4306
- 198
- Dennis Heidenreich
O Anidrides ácidos Eles são considerados de grande importância entre a ampla variedade de compostos de origem orgânica que existem. Estes são apresentados como moléculas que possuem dois grupos ácidos (substituintes orgânicos cuja fórmula é RCO-, onde R é uma cadeia de carbono) unida ao mesmo átomo de oxigênio.
Há também uma classe de anidridos ácidos que é comumente encontrado: anidridos carboxílicos, chamados porque o ácido inicial é um ácido carboxílico. Para citar aqueles desse tipo cuja estrutura é simétrica, apenas uma substituição de termos deve ser feita.

A expressão ácida deve ser substituída na nomenclatura de seu ácido carboxílico original pelo termo anidrido, o que significa "sem água", sem alterar o restante do nome da molécula formada. Esses compostos também podem ser gerados com base em um ou dois grupos ácidos de outros ácidos orgânicos, como ácido fosfônico ou ácido sulfônico.
Da mesma forma, os anidridos ácidos podem ser causados com base em um ácido inorgânico, como o ácido fosfórico. No entanto, suas propriedades físicas e químicas, suas aplicações e outras características dependem da síntese realizada e da estrutura de anidrido.
[TOC]
Como os anidridos ácidos são formados?
Alguns anidridos ácidos se originam de diferentes maneiras, seja em laboratório ou na indústria. Na síntese industrial, o anidrido acético é tomado como um exemplo, que é produzido principalmente pelo processo de carbonilação da molécula de acetato de metila.
Outro exemplo dessas síntese é o de anidrido malico, que é gerado através da oxidação da molécula de benzeno ou butano.
Pode servir você: hidróxido de zinco (Zn (OH) 2)No entanto, na síntese de ani -hidretos ácidos em laboratório, a ênfase é colocada na desidratação dos ácidos correspondentes, como a produção do anidrido etanico, no qual duas moléculas de ácido etaico são desidratadas para dar origem ao composto mencionado.
Também pode ocorrer uma desidratação intramolecular; Ou seja, dentro da mesma molécula de um ácido com dois grupos carboxil (ou dicarboxílico), mas se ocorre o oposto e um anidrido ácido sofre hidrólise, a regeneração dos ácidos que se originou ocorre.
Anidridos ácidos cujos substituintes acilos são iguais, enquanto em anidrids desse tipo considerados misturados essas moléculas são diferentes são diferentes.
No entanto, essas espécies também são geradas quando ocorre uma reação entre um halur ácido (cuja fórmula geral é A (rCOX)) com uma molécula de carboxilato (cuja fórmula geral é r'cooo-)))))))))))))))))))))))))))))))))))))))))))))))))))))))). [2]
Fórmula geral
A fórmula geral de anidridos ácidos é (RC (O))2Ou, o que é melhor observado na imagem colocada no início deste artigo.
Por exemplo, para anidrido acético (do ácido acético), a fórmula geral é (CH3CO)2Ou, escrevendo de maneira semelhante para muitos outros anidridos de ácido similares.
Como afirmado acima, esses compostos têm quase o mesmo nome de seus ácidos precursores, e a única coisa que muda é o termo ácido por anidrido, uma vez que as mesmas regras de numeração de átomos e substituintes devem ser seguidos para ter sucesso com sua nomenclatura.
Formulários
Os anidridos ácidos têm muitas funções ou aplicações, dependendo do campo que está sendo estudado, pois têm alta reatividade, podem ser reagentes precursores ou fazer parte de muitas reações importantes.
Pode atendê -lo: piróliseUm exemplo disso é a indústria, onde o anidrido acético é produzido em grandes quantidades, porque é a estrutura mais simples que pode ser isolada. Este anidrido é usado como um importante reagente orgânico, como ésteres de acetato.
Uso industrial
Por outro lado, o anidrido malico é mostrado com uma estrutura cíclica, sendo usada na produção de cobertura para uso industrial e como precursor de algumas resinas através do processo de copolimeterização com moléculas de Stretus. Além disso, esta substância serve como um dienófilo quando a reação de Diels-Alder é realizada.
Da mesma forma, existem compostos que possuem duas moléculas de anidrides ácidos em sua estrutura, como etystarboxylic ou dia -hidreto diaidrid.
Além disso, há um anidrido misto chamado 3'-fosfoadenosín-5'-fosfosulfato, de ácidos fosfóricos e sulfúrico, que constitui a coenzima mais comum nas reações de transferência de sulfato biológico.
Exemplos de anidrides ácidos
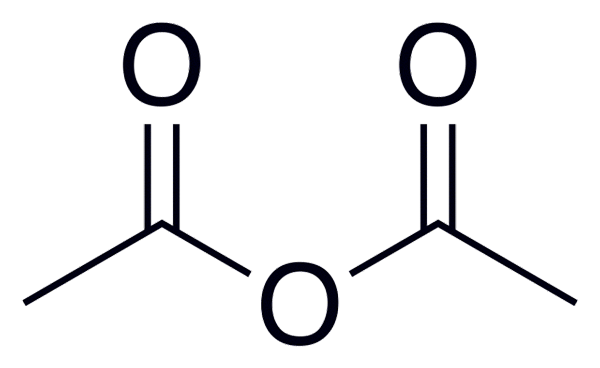 Anidrido acético
Anidrido acético Abaixo está uma lista com os nomes de alguns anidridos ácidos, para dar alguns exemplos desses compostos importantes na química orgânica que podem formar compostos de estrutura linear ou anéis de vários membros:
- Anidrido acético.
- Anidrido propanóico.
- Anidrido benzóico.
- Maleico anidrido.
- Anidrido succínico.
- Anidrido ftalical.
- Naftalente -tracarboxílico dia -hidreto.
- EtyterTarboxylic Diahydride.
- Benzoquinonteteterarboxílico dia -hidreto.
Assim como esses anidridos com oxigênio são formados, outros compostos são dados onde um átomo de enxofre pode substituir o oxigênio no grupo carbonil e no oxigênio central, como: por exemplo:
Pode atendê -lo: acetanilide (C8H9NO)- Anidrido tioacético (escolha3C (s)2QUALQUER)
Existe até o caso de duas moléculas de ácido que formam ligações com o mesmo átomo de enxofre; Esses compostos são chamados Tioanhdrides, a saber:
- Tioan -hidreto acético ((CH3CO))2S)
Referências
- Wikipedia. (2017). Wikipedia. Recuperado de.Wikipedia.org
- Johnson, a. C. (1999). Convite para química orgânica. Recuperado de livros.Google.co.ir.
- Acton, q. PARA. (2011). Hidrolas de anidrido ácido: avanços na pesquisa e aplicação. Recuperado de livros.Google.co.ir
- Bruckner, r., E Harmata, M. (2010). Mecanismos orgânicos: reações, estereoquímica e síntese. Recuperado de livros.Google.co.ir
- Kim, J. H., Gibb, h. J., e Iannucci, para. (2009). Anidridos de ácido cíclico: aspectos de saúde humana. Recuperado de livros.Google.co.ir
- « Tipos de baterias, características e reações
- Biografia de Julia Pastrana, Doença, Relacionamentos »

