Anidrides

- 3366
- 630
- Tim Mann
O que são anidridados?
O Anidrides São compostos químicos que se originam da união de duas moléculas pela libertação da água. Assim, pode ser visto como uma desidratação das substâncias iniciais; Embora não seja precisamente verdadeiro.
Na química orgânica e inorgânica, eles são mencionados e, em ambos os ramos, seu entendimento difere de um grau apreciável. Por exemplo, na química inorgânica, são considerados óxidos básicos e ácidos, como anidias de seus hidróxidos e ácidos, respectivamente, uma vez que o primeiro reage com a água para formar o segundo.
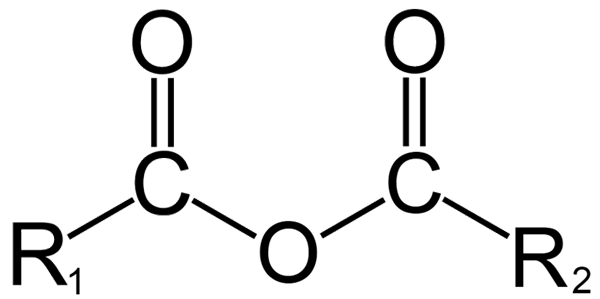 Estrutura geral de anidrides. Fonte: Dremmetbrownie [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)], da Wikimedia Commons
Estrutura geral de anidrides. Fonte: Dremmetbrownie [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)], da Wikimedia Commons Aqui, uma confusão entre os termos 'anidro' e 'Anhidrido' pode ser gerada. Geralmente, o anidro refere -se a um composto ao qual foi desidratado sem alterações em sua natureza química (não há reação); Enquanto com um anidrido, há uma mudança química, refletida na estrutura molecular.
Se os hidróxidos e ácidos correspondentes (ou anidridos) forem comparados, será observado que houve uma reação. Por outro lado, alguns óxidos ou sais podem ser hidratados, perder água e continuar sendo os mesmos compostos; Mas, sem água, isto é, Anhydros.
Na química orgânica, por outro lado, o que é entendido pelo anidrido é a definição inicial. Por exemplo, um dos anidridos mais conhecidos são os derivados de ácidos carboxílicos (imagem superior). Estes consistem na união de dois grupos acil (-RCO) através de um átomo de oxigênio.
Em sua estrutura geral, r é indicado1 Para um grupo acil e r2 Para o segundo grupo Acilo. Porque r1 e r2 Eles são diferentes, vêm de diferentes ácidos carboxílicos e depois é um anidrido de ácido assimétrico. Quando ambos os substituintes r (aromáticos) são os mesmos, se fala nesse caso de um anidrido de ácido simétrico.
No momento de vincular dois ácidos carboxílicos para formar anidrido, a água pode ou não se formar, assim como outros compostos. Tudo vai depender da estrutura desses ácidos.
Propriedades de Anhidrid
As propriedades dos anidrides dependerão de qual está se referindo. Quase todo mundo tem em comum que eles reagem com água. No entanto, para os anidrides básicos de chamados tão chamados em inorgânicos, vários deles são até insolúveis em água (MGO); portanto, essa afirmação se concentrará nos anidrides dos ácidos carboxílicos.
Pontos de fusão e ebulição caem na estrutura molecular e interações intermoleculares para (RCO)2Ou, sendo esta a fórmula química geral desses compostos orgânicos.
Se a massa molecular de (RCO)2Ou é baixo, provavelmente é um líquido incolor à temperatura ambiente e pressão. Por exemplo, anidrido acético (ou ehydridge3CO)2Ou é um líquido e a importância industrial mais importante, sendo sua produção muito vasta.
A reação entre anidrido acético e água é representado pela seguinte equação química:
(CH3CO)2Ou + h2O => 2CH3COOH
Observe que quando a molécula de água é adicionada, duas moléculas de ácido acético são liberadas. A reação reversa, no entanto, não pode ocorrer para o ácido acético:
Pode atendê-lo: equilíbrio de vapor líquido2CH3COOH => (CHO3CO)2Ou + h2Ou (não acontece)
É necessário recorrer a outra rota sintética. Os ácidos dicarboxílicos, por outro lado, podem fazê -lo aquecendo; Mas será explicado na próxima seção.
Reações químicas
Hidrólise
Uma das reações mais simples de anidrides é a hidrólise, que acaba de ser mostrada para anidrido acético. Além deste exemplo, existe o de anidrido de ácido sulfúrico:
H2S2QUALQUER7 + H2Ou 2h2SW4
Aqui você tem um anidrido de ácido inorgânico. Observe que para H2S2QUALQUER7 (Também chamado de ácido dissulfúrico), a reação é reversível, então aquecimento H2SW4 concentrado resulta na formação de seu anidrido. Se, por outro lado, é uma solução diluída de H2SW4, É lançado então3, Anidrido sulfúrico.
Esterificação
Os anidridos ácidos reagem com álcoois, com piridina no meio, para dar origem a um éster e um ácido carboxílico. Por exemplo, é considerada a reação entre anidrido acético e etanol:
(CH3CO)2Ou + ch3CH2Oh => CHO3Co2CH2CH3 + CH3COOH
Assim formando o éster Ethyl Etano, CH3Co2CH2CH3, e ácido etano (ácido acético).
Praticamente, o que acontece é a substituição do hidrogênio do grupo hidroxila, por um grupo de Aquilus:
R1-Oh => r1-OCOR2
No caso de (CH3CO)2Ou, seu grupo Acilo é o -Coch3. Portanto, diz -se que o grupo OH está passando por acilação. No entanto, a acilação e a esterificação não são conceitos intercambiáveis; A ação pode ocorrer diretamente em um anel aromático, conhecido como nome de acilação de Friedel-Crafts.
Assim, os álcoois na presença de anidridos ácidos são esterificados por acilação.
Por outro lado, apenas um dos dois grupos ácidos reage com álcool, o outro permanece com o hidrogênio formando um ácido carboxílico; que no caso de (Cho3CO)2Ou, é ácido etanóico.
Amidation
Os anidridos ácidos reagem com amônia ou aminas (primária e secundária), para dar origem a amidas. A reação é muito semelhante à esterificação recém -descrita, mas o ROH é substituído por uma amina; Por exemplo, uma amina secundária, r2NH.
Novamente, a reação entre (CH3CO)2Ou e dietilamina, ET2NH:
(CH3CO)2O + 2et2NH => CH3Cont2 + CH3COO- +NH2Et2
E dietilacetamida são formadas, CHO3Cont2, e um sal de amônio carboxilado, Cho3COO- +NH2Et2.
Embora a equação possa parecer um pouco difícil de entender, é suficiente observar como o grupo -Coch3 Substitua o H de um ET2NH para formar o Amida:
Et2NH => ET2NCOCH3
Mais do que um meio, a reação ainda é a acilação. Tudo está resumido nessa palavra; Desta vez, a Amina sofre de acilação e não álcool.
Como estão os anidridados?
Os anidridos inorgânicos são formados reagindo o elemento com oxigênio. Assim, se o elemento for metálico, é formado um óxido metálico básico; E se não for -metálico, é formado um óxido não metálico ou anidrido ácido.
Pode atendê-lo: Clausius clapeyron Equação: Para que é, exemplos, exercíciosPara anidridos orgânicos, a reação é outra. Dois ácidos carboxílicos não podem se juntar diretamente para liberar água e formar ácido anidrido; A participação de um composto que ainda não foi mencionado: o cloreto de acila, rcocl é necessário.
O ácido carboxílico reage com cloreto ácido, produzindo o respectivo hidreto e cloreto de hidrogênio:
R1Cocl + R2COOH => (r1CO) ou (COR2) + Hcl
CH3Cocl + ch3COOH => (CHO3CO)2O + hcl
A Ch3 vem do grupo acetil, Cho3Co- e o outro já está presente no ácido acético. A escolha de um cloreto de ácido específico, bem como o ácido carboxílico, pode dar origem à síntese de um anidrido de ácido simétrico ou assimétrico.
Anidridos cíclicos
Ao contrário dos outros ácidos carboxílicos que requerem cloreto ácido, os ácidos dicarboxílicos podem se condensar em seu anidrido correspondente. Para fazer isso, é necessário aquecê -los para promover a liberação de h2QUALQUER. Por exemplo, a formação de anidrido ftálico é mostrado a partir de ácido fotal.
 Formação de anidrido ftalical. Fonte: Jü [Domínio Público], da Wikimedia Commons
Formação de anidrido ftalical. Fonte: Jü [Domínio Público], da Wikimedia Commons Observe como o anel pentagonal é concluído e o oxigênio que se junta aos dois grupos C = O faz parte dele; Este é um anidrido cíclico. Também pode ser visto que o anidrido ftálico é um anidrido simétrico, já que tanto r1 como r2 Eles são idênticos: um anel aromático.
Nem todos os ácidos dicarboxílicos são capazes de formar seu anidrido, pois quando seus grupos de COOH são muito separados, eles são forçados a completar anéis cada vez maiores. O maior anel que pode ser formado é um hexagonal, maior do que a reação não ocorre.
Nomenclatura
Como os anidrides são nomeados? Deixando de lado os inorgânicos, relevantes para questões de óxido, os nomes de anidrids orgânicos até agora explicam que dependem da identidade de r1 e r2; isto é, de seus grupos acil.
Se os dois R forem iguais, é suficiente para substituir a palavra 'ácido' por 'Anhidrídeo' no respectivo nome do ácido carboxílico. E se, pelo contrário, os dois são diferentes, eles são nomeados em ordem alfabética. Portanto, para saber como chamá -lo, você deve ver primeiro se for um anidrido simétrico ou assimétrico.
O ch3CO)2Ou é simétrico, já que r1= R2 = Cap3. Deriva do ácido acético ou etanóico, então seu nome é, seguindo a explicação anterior: anidrido acético ou etanóico. O mesmo acontece com o anidrido fthálico acabado de mencionar.
Suponha que você tenha o seguinte anidrido:
CH3CO (O) Coch2CH2CH2CH2CH2CH3
O grupo acetil à esquerda vem do ácido acético, e isso à direita, do ácido heptanóico. Para nomear este anidrido, você deve nomear seus grupos R em ordem alfabética. Então, o nome dele é: anidrido acético heptanóico.
Formulários
Os anidridos inorgânicos têm aplicações infinitas, a partir da síntese e formulação de materiais, cerâmica, catalisadores, cimentos, eletrodos, fertilizantes, etc., Até o revestimento da crosta terrestre com seus milhares de minerais de ferro e alumínio, e o dióxido de carbono exalado por organismos vivos.
Pode atendê -lo: decantação: conceito, exemplos e tiposEles representam a fonte inicial, o ponto em que muitos compostos usados na síntese inorgânica derivam. Um dos anidridos mais importantes é o de carbônico, CO2. É, juntamente com a água, essencial para a fotossíntese. E em nível industrial, o SO3 É essencial, pois o ácido sulfúrico réu é obtido dele.
Talvez, o anidrido com mais aplicações e por ter (desde que haja vida) seja do ácido fosfórico: o triifosfato de adenosina, mais conhecido como ATP, presente no DNA e "moeda energética" do metabolismo.
Anidrides orgânicos
Os anidridos ácidos reagem através da acilação, a um álcool, formando um éster, uma amina, dando origem a uma amida ou um anel aromático.
Existem milhões de cada um desses compostos e centenas de milhares de opções de ácido carboxílico para preparar um anidrido; Portanto, as possibilidades sintéticas crescem drasticamente.
Assim, uma das principais aplicações é incorporar um grupo ácido em um composto, substituindo um dos átomos ou grupos de sua estrutura.
Cada dióxido separadamente tem suas próprias aplicações, mas em termos gerais todos eles reagem de uma maneira semelhante. Por esse motivo, esses tipos de compostos são usados para modificar estruturas poliméricas, criando novos polímeros; isto é, copolímeros, resinas, revestimentos, etc.
Por exemplo, o anidrido acético é usado para acetilar todos os grupos OH da celulose (imagem inferior). Com isso, cada H do OH é substituído por um grupo acetil, Coch3.
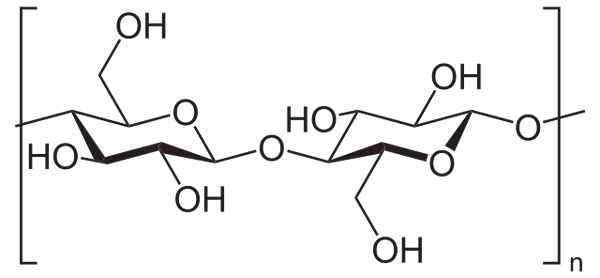 Celulose. Fonte: Neurotoger [Domínio Público], da Wikimedia Commons
Celulose. Fonte: Neurotoger [Domínio Público], da Wikimedia Commons Dessa maneira, o polímero de acetato de celulose é obtido. A mesma reação pode ser esboçada com outras estruturas poliméricas com grupos NH2, Também suscetível à acilação.
Essas reações de acilação também são úteis para a síntese de medicamentos, como aspirina (ácido acetilsalicílico).
Exemplos
Eles são mostrados para terminar alguns outros exemplos de anidos orgânicos. Embora eles não os mencionem, os átomos de oxigênio podem ser substituídos por enxofre, dando anidridos sulfurizados ou mesmo fósforo.
-C6H5Co (O) Cook6H5: Anidrido benzóico. Grupo c6H5 representa um anel de benzeno. Sua hidrólise produz dois ácidos benzóicos.
-HCO (O) COH: ANHIDRID FORMIC. Sua hidrólise produz dois ácidos fórmicos.
- C6H5CO (O) Coch2CH3: Anidrido benzóico propanóico. Sua hidrólise produz ácidos benzóicos e propânicos.
-C6HonzeCo (O) Cook6Honze: Cyclohexanocroboxylicanight Anydrid. Ao contrário dos anéis aromáticos, estes estão saturados, sem links duplos.
-CH3CH2CH2CO (O) Coch2CH3: Anidrido butanico propanóico.
Anidrido succínico
 Anidrido succínico. Fonte: Ninjatacoshell [Domínio Público], da Wikimedia Commons
Anidrido succínico. Fonte: Ninjatacoshell [Domínio Público], da Wikimedia Commons Aqui você tem outro cíclico, derivado do ácido sucínico, um ácido dicarboxílico. Nota como os três átomos de oxigênio traíam a natureza química desse tipo de composto.
O anidrido malico é muito semelhante ao da succínica, com a diferença de que existe uma ligação dupla entre os carbonos que formam a base do pentágono.
Anidrido glutariano
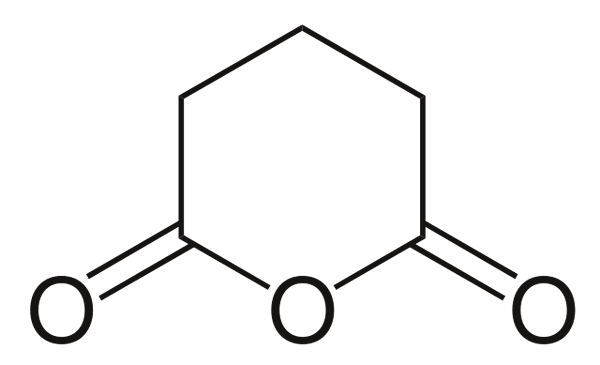 Anidrido glutariano. Fonte: Choij [Domínio Público], da Wikimedia Commons
Anidrido glutariano. Fonte: Choij [Domínio Público], da Wikimedia Commons E finalmente o anidrido de ácido glutarico é mostrado. Isso distingue estruturalmente todos os outros, consistindo em um anel hexagonal. Novamente, os três átomos de oxigênio se destacam na estrutura.
Outros anidridos mais complexos sempre podem ser evidenciados pelos três átomos de oxigênio muito próximos um do outro.
Referências
- Anidrido. Enclyclopaedia britannica. Recuperado de: Britannica.com
- Definição de anidrido ácido em química. Recuperado de: pensamento.com

