Estrutura de álcool terciário, propriedades, exemplos
- 1613
- 395
- Conrad Schmidt
A Álcool terciário É aquele em que o grupo hidroxila, OH, está ligado a um carbono terciário. Sua fórmula continua sendo ROH, como outros álcoois; Mas é facilmente reconhecido porque oh está próximo de um x na estrutura molecular. Além disso, sua cadeia carbonatada é geralmente mais curta e sua maior massa molecular.
Então, um álcool terciário tende a ser mais pesado, é mais ramificado e também é o menos reativo em relação à oxidação; isto é, não pode ser transformado em um ctone ou ácido carboxílico, como ocorre com álcoois secundários e primários, respectivamente.
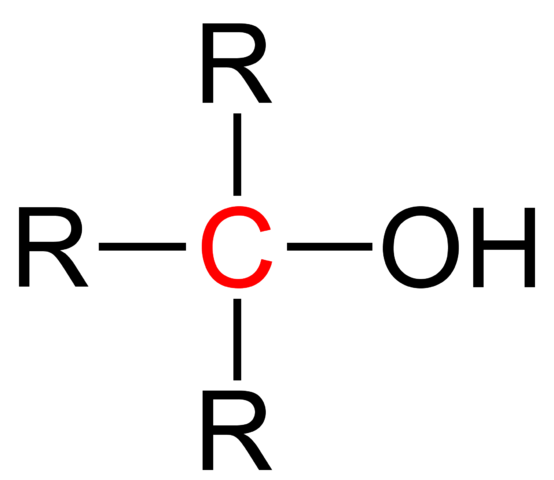
 Fórmula estrutural de um álcool terciário. Fonte: Jü [domínio público].
Fórmula estrutural de um álcool terciário. Fonte: Jü [domínio público]. A fórmula estrutural geral para um álcool terciário é mostrada na imagem superior. Segundo ela, uma nova fórmula do tipo R poderia ser escrita3CoH, onde R pode ser um grupo alquil ou aril; Um grupo de metilo, CH3, ou uma cadeia curta ou longa carbonatada.
Se os três grupos R forem diferentes, o carbono central do álcool terciário será quiral; isto é, o álcool apresentará atividade óptica. Por esse fato, os álcoois terciários cobram juros dentro da indústria farmacêutica, pois de cetonas com atividade biológica esses álcoois são sintetizados com estruturas mais complexas.
[TOC]
Estrutura de um álcool terciário
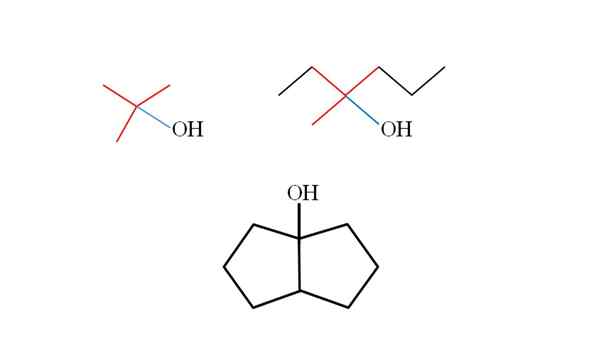 Três álcoois terciários e suas estruturas. Fonte: Gabriel Bolívar.
Três álcoois terciários e suas estruturas. Fonte: Gabriel Bolívar. Considere as estruturas dos álcoois terciários superiores para aprender a reconhecê -los, independentemente do composto. O carbono ligado ao OH também deve estar ligado a outros três carbonos. Se for observado em detalhes, os três álcoois cumprem isso.
O primeiro álcool (à esquerda), consiste em três grupos CH3 Carbono central ligado, cuja fórmula seria (Cho3)3Coh. O grupo de aluguel (escolha3)3C- é conhecido como tertbutil.
Pode servir a você: potenciômetro (famétrico)O segundo álcool (à direita) tem o Central Carbon Lin3, CH3CH2 e cap2CH2CH3. Como os três grupos são diferentes, o álcool é quiral e, portanto, exibe atividade óptica. Um T não é observado aqui, mas um X próximo a OH (vermelho e azul).
E no terceiro álcool (abaixo e sem cores), o OH está ligado a um dos dois carbonos que se juntam a dois ciclopentano. Este álcool não apresenta atividade óptica porque dois dos grupos ligados a carbono central são idênticos. Como o segundo álcool, se for cuidadosamente observado, um X (mais um tetraedro) também será encontrado.
Impedimento estérico
Os três álcoois superiores têm algo mais em comum do que um carbono X: Central é prevenido estericamente; isto é, existem muitos átomos que o cercam no espaço. Uma conseqüência imediata disso é que os nucleófilos, ansiosos por acusações positivas, têm dificuldades para abordar esse carbono.
Por outro lado, com três carbono ligado ao carbono central, eles doam parte da densidade eletrônica que o átomo eletronegativo do oxigênio o subtrai, estabilizando -o ainda mais na frente desses ataques nucleofílicos. No entanto, o álcool terciário pode sofrer substituição ao formar carbocação.
Propriedades
Físico
Os 3º álcoois geralmente apresentam estruturas altamente ramificadas. Uma primeira consequência disso é que o grupo OH é impedido e, portanto, seu momento dipolar exerce um efeito menor nas moléculas vizinhas.
Isso se traduz em interações moleculares mais fracas em comparação com as de álcoois primários e secundários.
Pode servir a você: Princípio de Le ChâtelierPor exemplo, considere os isômeros estruturais do butanol:
CH3CH2CH2Oh (n-Butanol, peb = 117ºC)
(CH3)2CH2OH (álcool isobutílico, peb = 107ºC)
CH3CH2Ch (oh) ch3 (Álcool Secutílico, PEB = 98ºC)
(CH3)3CoH (álcool tercutílico, peb = 82ºC)
Observe como os pontos de ebulição descem à medida que o isômero se torna mais ramificado.
A princípio, foi mencionado que nas estruturas dos álcoois 3 é observado, o que por si só indica um ramo alto. É por isso que esses álcoois tendem a ter menor derretimento e/ou pontos de ebulição.
Um pouco semelhante é o caso da sua miscibilidade com água. Quanto mais impedia, menos miscível oh será álcool 3 com água. No entanto, essa miscibilidade diminui quanto mais a cadeia de carbono; Assim, o álcool térmico é mais solúvel e miscível com água do que o n-Butanol.
Acidez
Álcoois terciários tendem a ser os menos ácidos de todos. As razões são numerosas e se relacionam. Em contas de resumo, a carga negativa de seu alcoxide derivado, vermelho-, Você sentirá uma forte repulsão para os três grupos alcais ligados ao carbono central, enfraquecendo o ânion.
Quanto mais instável o ânion, menor a acidez do álcool será.
Reatividade
3º álcoois não podem sofrer oxidações com cetonas (r2C = o) ou aldeído (rcho) ou ácidos carboxílicos (rcooh). Por um lado, eu teria que perder um ou dois carbonos (na forma de CO2) oxidar, o que diminui sua reatividade contra a oxidação; E por outro, falta hidrogênio que possa perder para formar outro vínculo com oxigênio.
Pode servir a você: piridina: estrutura, propriedades, usos, toxicidade, sínteseNo entanto, eles podem sofrer substituição e eliminação (formação de uma ligação dupla, alceno ou olefina).
Nomenclatura
A nomenclatura para esses álcoois não é diferente do de outros. Existem nomes comuns ou tradicionais, e os nomes sistemáticos governados pelo IUPAC.
Se a cadeia principal e suas ramificações consistirem em um grupo de aluguel reconhecido, ela é usada para seu nome tradicional; Quando não é possível fazê -lo, a nomenclatura da IUPAC é usada.
Por exemplo, considere o seguinte álcool terciário:
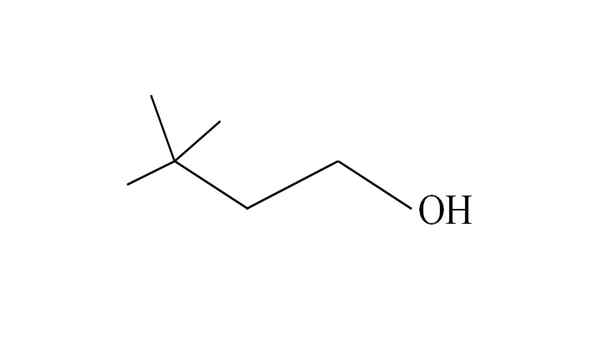 3.3-dimetil-1-butanol. Fonte: Gabriel Bolívar.
3.3-dimetil-1-butanol. Fonte: Gabriel Bolívar. Começa a enumerar carbonos da direita para a esquerda. No C-3, existem dois grupos CH3 de substituintes e, portanto, o nome deste álcool é 3,3-dimetil-1-butanol (a cadeia principal tem quatro carbonos).
Da mesma forma, toda a cadeia e suas ramificações consistem no grupo neohexilo; Portanto, seu nome tradicional pode ser álcool neohexílico, ou neohexanol.
Exemplos
Finalmente, são mencionados alguns exemplos de álcoois terciários:
-2-metil-2-propanol
-3-metil-3-hexanol
-Biciclo [3,3,0] Octan-1-OL
-2-metil-2-butanol: cap3CH2CoH (cap3)2
As fórmulas dos três primeiras álcoois são representadas na primeira imagem.
Referências
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Morrison, r. T. e boyd, r, n. (1987). Quimica Organica. (5ª edição). Interamericano Editorial Addison-Wesley.
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. Aminas. (10ª edição.). Wiley Plus.
- Gunawardena Gamini. (31 de janeiro de 2016). Álcool terciário. Química Librettexts. Recuperado de: química.Librettexts.org
- Ashenhurst James. (16 de junho de 2010). Álcoois (1) - Nomenclatura e propriedades. Recuperado de: MasterorganicChemistry.com
- Clark J. (2015). Apresentando álcoois. Recuperado de: Chemguide.co.Reino Unido
- Quimica Organica. (s.F.). Tema 3. Álcoons. [PDF]. Recuperado de: Sinorg.Uji.é
- Nilanjana Majumdar. (3 de março de 2019). Síntese de álcool terciário quiral: desenvolvimentos significativos. Recuperado de: 2.Química.MSU.Edu
- « Período formativo de origem, características, produtos da América
- Como foi a sociedade européia na primeira metade do século XIX »

