Álcool secundário o que é, estrutura, propriedades, usa
- 2315
- 96
- Alfred Kub
O que é um álcool secundário?
A Álcool secundário Possui carbono carbono do grupo hidroxila (OH), anexado a dois carbonos. Enquanto isso, no álcool primário, o carbono do grupo hidroxila está ligado a um átomo de carbono e no álcool terciário ligado a três átomos de carbono.
Os álcoois são ácidos um pouco mais fracos que a água, com a seguinte PKA: água (15,7); Álcoois metílicos (15,2), etil (16), isopropil (álcool secundário, 17) e térmico (18). Como pode ser visto, o álcool isopropílico é menos ácido que os álcoois metílicos e etílicos.
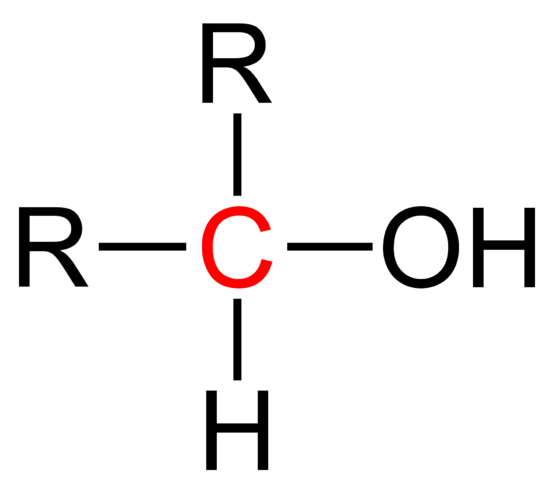
 Fórmula estrutural de um álcool secundário. Wikimedia Commons
Fórmula estrutural de um álcool secundário. Wikimedia Commons Na imagem superior, a fórmula estrutural para um álcool secundário é mostrada. O carbono vermelho é o portador de OH e está ligado a dois grupos alquil (ou aril) R e um único átomo de hidrogênio.
Todos os álcoois têm a fórmula genérica do ROH; Mas se o carbono do portador for observado em detalhes, os álcoois primários serão obtidos (RCH2Oh), secundário (r2Choh, criado aqui), e terciário (r3Coh). Este fato faz a diferença em suas propriedades físicas e reatividade.
Estrutura de um álcool secundário
As estruturas de álcool dependem da natureza dos grupos R. No entanto, para álcoois secundários, alguma exemplificação pode ser feita, considerando que só pode haver estruturas lineares com ou sem ramificações ou estruturas cíclicas. Por exemplo, você tem a seguinte imagem:
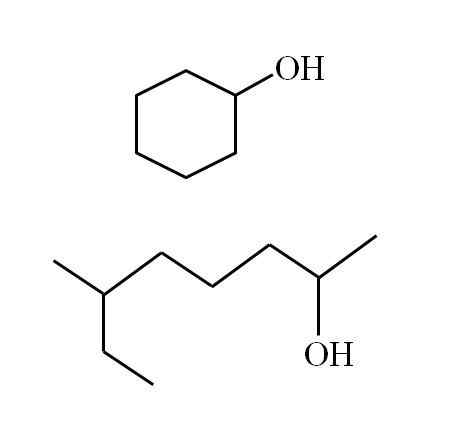 Um álcool secundário cíclico e outra corrente ramificada. Fonte: Gabriel Bolívar
Um álcool secundário cíclico e outra corrente ramificada. Fonte: Gabriel Bolívar Observe que, para ambas as estruturas, há algo em comum: oh está ligado a um "V". Cada extremidade do V representa um grupo igual (parte superior da imagem, estrutura cíclica) ou diferente (parte inferior, cadeia ramificada).
Dessa forma, qualquer álcool secundário é facilmente identificado, mesmo que sua nomenclatura seja desconhecida.
Propriedades
Pontos de ebulição
As propriedades dos álcoois secundários não diferem muito de outros álcoois. Eles geralmente são líquidos transparentes e, para serem sólidos à temperatura ambiente, precisa formar várias pontes de hidrogênio e ter alta massa molecular.
Pode atendê -lo: ácido perbrômico (hbro4): propriedades, riscos e usosNo entanto, a mesma fórmula estrutural R2Choh sugere certas propriedades únicas em geral para esses álcoois. Por exemplo, o grupo OH está menos exposto e está disponível para interações com pontes de hidrogênio, r2CH-OH-OHCHR2.
Isso ocorre porque os grupos R, adjacentes ao carbono do carro, podem ser trazidos e impedir a formação de pontes de hidrogênio. Como resultado, os álcoois secundários têm pontos de ebulição mais baixos do que o primário (rch2OH).
Acidez
De acordo com a definição de Brönsted-Lowry, um ácido é aquele que doa prótons ou íons de hidrogênio, h+. Quando isso acontece com um álcool secundário, você tem:
R2Choh + b- => R2Cho- + Hb
O conjugado ras2Cho-, Ânion alcoxídico, sua carga negativa deve se estabilizar. Para o álcool secundário, a estabilização é menor, pois os dois grupos R têm densidade eletrônica, o que repele a carga negativa no átomo de oxigênio até certo ponto.
Enquanto isso, para o ânion alcóxido de um álcool primário, RCH2QUALQUER-, Há menos repulsão eletrônica com apenas um grupo R e não dois. Além disso, os átomos de hidrogênio não exercem repulsão significativa e, pelo contrário, contribuem para estabilizar a carga negativa.
Portanto, os álcoois secundários são menos ácidos que os álcoois primários. Se é assim, eles são mais básicos e precisamente pelos mesmos motivos:
R2CHOH + H2B+ => R2Choh2+ + Hb
Agora, os grupos R estabilizam a carga positiva de oxigênio, dando parte de sua densidade eletrônica.
Reações
Hidrogênio halogenogeneto e fósforo trihalogeneto
Um álcool secundário pode reagir com hidrogênio halogenídeo. A equação química da reação entre álcool isopropílico e ácido bromtérico é mostrada em um meio de ácido sulfúrico e produzindo brometo de isopropil:
CH3Chohch3 + Hbr => ch3Chbrch3 + H2QUALQUER
E você também pode reagir com um trihalogenuero de fósforo, px3 (X = br, i):
Pode atendê -lo: hidróxido de níquel (iii): estrutura, propriedades, usos, riscosCH3-Choh-ch2-CH2-CH3 + Pbr3 => CH3-CHBR-CH2-CH2-CH3 + H3Po3
O produto químico acima corresponde à reação entre a seção e o tribromto de fósforo, causando o brometo de Sec-Pentil.
Observe que em ambas as reações, há uma halogeneto de alquil secundária (r2Chx).
Desidratação
Nesta reação, um H e um OH de carbonos vizinhos são perdidos, formando uma ligação dupla entre esses dois átomos de carbono. Portanto, há a formação de um alceno. A reação requer um catalisador ácido e suprimento de calor.
Álcool => alceno + h2QUALQUER
Você tem, por exemplo, a seguinte reação:
Ciclohexanol => ciclohexeno + h2QUALQUER
Reação com metais ativos
Os álcoois secundários podem reagir com metais:
CH3-Choh-ch3 + K => CHO3Cho-K+CH3 + ½ h+
Aqui o álcool isopropílico reage com potássio para formar isopróxido de potássio e íons de hidrogênio.
Esterificação
O álcool secundário reage com um ácido carboxílico para originar um éster. Por exemplo, a equação química da reação do álcool secreto é mostrada com ácido acético, para produzir acetato semi-butil:
CH3Chohch2CH3 + CH3COOH CH3Coochch3CH2CH3
Oxidação
Os álcoois primários oxidam aldeídos, e estes, por sua vez, oxidam os ácidos carboxílicos. Mas, os álcoois secundários oxidam a acetona. As reações são geralmente catalisadas pelo dicromato de potássio (k2Cro7) e ácido crômico (H2Cro4).
A reação global é:
R2Choh => r2C = O
Nomenclatura
Os álcoois secundários são nomeados apontando para a posição do grupo OH na cadeia principal (mais longa). Este número precede o nome ou pode ir atrás do nome do respectivo Alkane para a referida cadeia.
Por exemplo, Cho3CH2CH2CH2Chohch3, É o 2-hexanol ou hexan-2-to.
Se a estrutura for cíclica, não há necessidade de colocar um numerador; A menos que haja outros substituintes. É por isso que o álcool cíclico da segunda imagem é chamado de ciclohexanol (o anel é hexagonal).
Pode atendê -lo: aminesE para o outro álcool da mesma imagem (o ramificado), seu nome é: 6-etil-heptan-2 -ol.
Formulários
-O SEC-Butanol é usado como solvente e químico intermediário. Está presente nos fluidos hidráulicos para freios, limpadores industriais, polimento, fios, agentes de flutuação mineral e frutas e essências de perfume.
-O álcool isopropanol é usado como solvente industrial e como anticoagulante. É usado em óleos e tintas de secagem rápida, como anti -séptico e substituto para o etanol de cosméticos (por exemplo: loções de pele, tônico capilar e álcool de fricção).
-O isopropanol é um ingrediente de sabonetes líquidos, limpeza de cristais, aromatizadores sintéticos de bebidas não alcoólicas e alimentos. Além disso, é um produto químico intermediário.
-O ciclohexanol é usado como solvente, no acabamento do tecido, no processamento de couro e sabonetes emulsificantes e detergentes sintéticos.
-O metilciclohexanol é um ingrediente de produtos de mascar com base em sabão e detergentes para tecidos especiais.
Exemplos
2-OCTHANOL
 Molécula de 2-Otanol. Fonte: Jü [Domínio Público], da Wikimedia Commons
Molécula de 2-Otanol. Fonte: Jü [Domínio Público], da Wikimedia Commons É um álcool gordo. É um líquido incolor, pouco solúvel em água, mas solúvel na maioria dos solventes não polares. É usado, entre outros usos, na elaboração de sabores e fragrâncias, pinturas e revestimentos, tintas, adesivos, cuidados domésticos e lubrificantes.
Estradiol ou 17β-estradiol
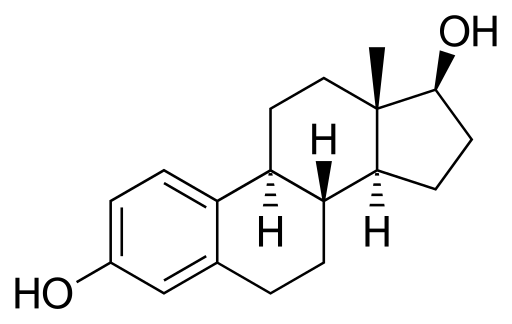 Molécula de Estradiol. Fonte: Neurotoger [Domínio Público], da Wikimedia Commons
Molécula de Estradiol. Fonte: Neurotoger [Domínio Público], da Wikimedia Commons É um hormônio sexual esteróide. Tem dois grupos hidroxilli em sua estrutura. É o estrogênio predominante durante os anos reprodutivos.
20-hidroxi-leukotrieno
É um metabolito que provavelmente se origina da oxidação do lipídio de leucotrieno. É classificado como um leucotrieno cistinil. Esses compostos são mediadores do processo inflamatório que contribui para as características fisiopatológicas da rinite alérgica.
2-heptanol
É um álcool encontrado em frutas. Além disso, é encontrado em óleo de gengibre e morangos. É transparente, incolor e insolúvel em água. É usado como solvente de várias resinas e intervém na fase de flutuação no processamento mineral.
Referências
- Enciclopédia de saúde e segurança no trabalho. (s.F.). Álcoons. [PDF]. Recuperado de: insht.é
- Estrutura e classificação de álcoois. Química Librettexts. Recuperado de: química.Librettexts.org
- « Tlachichinole o que é, características, benefícios, aplicação
- História e significado da bandeira do Iraque »

