Estrutura de álcool etílico, propriedades, usos, obtenção
- 3203
- 521
- Dennis Heidenreich
Ele Álcool etílico ou etanol É um composto orgânico cuja fórmula é c2H5Oh ou ch3CH2Oh, apresentando -se como um líquido incolor. Este é o segundo álcool primário mais simples de todos depois do metanol. É muito solúvel em água e em muitos solventes orgânicos, o que permitiu o desenvolvimento de muitas de suas aplicações.
Este álcool tem sido usado como anti -séptico e desinfetante, além de seu uso na síntese de medicamentos e outros produtos químicos orgânicos. Também tem sido usado como combustível no aquecedor, lâmpadas e em combinação com gasolina em veículos a motor.

A fermentação do açúcar para a produção de etanol é uma das primeiras reações químicas que o homem primitivo aprendeu. Uma cerâmica de 9000 anos foi encontrada na China.
Mas a fermentação dos açúcares só produziu uma solução de etanol muito baixa, e é por isso que foi necessário aprender técnicas de destilação para eliminar a água e concentrar o álcool. Assim, alquimistas gregos que trabalharam em Alexandria no século I.C., Eles já conheciam e usaram destilação.
No entanto, existem rotas sintéticas que permitem a obtenção de etanol totalmente puro baseado em etileno, que é destilado do óleo. Portanto, o petróleo é uma fonte indireta de etanol. Dessa maneira, etanol ou álcool absoluto são obtidos.
[TOC]
Estrutura de álcool etílico
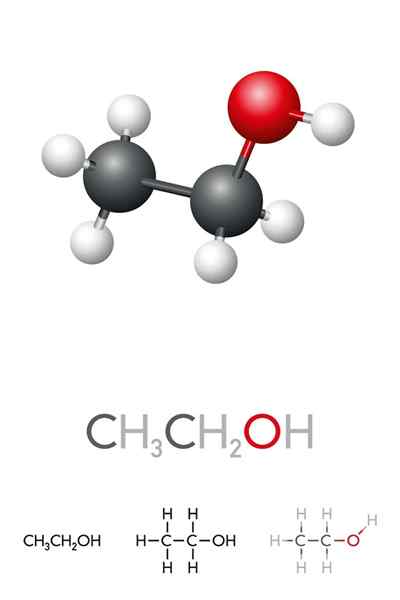
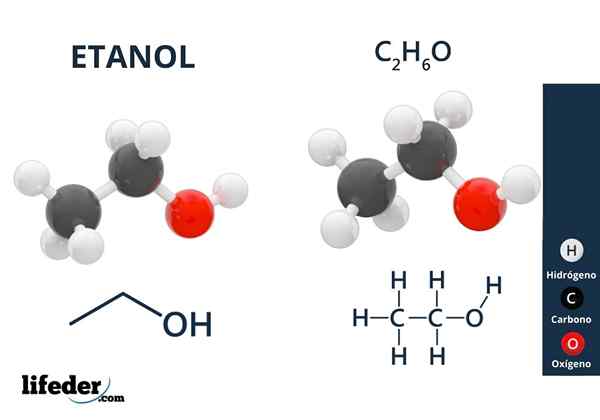
Na imagem superior, temos a estrutura molecular do etanol, Cho3-CH2-Oh, representado por um modelo de espaço completo. É um molecular bastante polar, uma vez que o grupo OH atrai a densidade eletrônica para si mesma do esqueleto de carbono ao qual está ligado.
Como resultado, as moléculas de álcool etílico interagem através do dipolo-dipol3CH2Oh-ohch2CH3. É por isso que esse álcool tem um ponto de ebulição alto em comparação com outros solventes ou líquidos orgânicos.
Propriedades
Aparência física
Líquido incolor.
Massa molar
46.069 g/mol
Cheiro
Cheiro suave e semelhante ao vinho.
Sabor
Queimar.
Densidade
0.789 g/cm3 A 20 ºC
Ponto de fusão
- 114.14 ºC
Ponto de ebulição
78.24 ºC
Solubilidade em água
1 · 106 mg/l. Isto é, é praticamente miscível em todas as proporções.
Miscibilidade com solventes orgânicos
O etanol é miscível com ácido acético, acetona, benzeno, tetracloreto de carbono, clorofórmio, éter de mergulho, etileno glicol, glicerol, piridina e tolueno. Também é miscível com hidrocarbonetos alifáticos leves, como Pentano e Hexano.
Coeficiente de partição de octanol/água
Log p = - 0.31
Pressão de vapor
59.3 mm Hg a 25 ºC. Portanto, descartou uma quantidade perceptível de vapores.
Pode servir você: cloreto de bário (BACL2)Densidade do vapor
1.59 no relacionamento aéreo tomado como unidade (1)
ponto de ignição
13 ºC
Temperatura de auto -dirigir
363 ºC
Calor de combustão
1336.8 kJ/mol a 25 ºC
Combustão
O etanol é um líquido volátil que queima com uma chama azul, sem fumaça, e isso é praticamente invisível à luz natural.
Calor específico
0.618 cal/g a 23 ° C
Gosma
1.2 mpa · s a 20 ºC
Índice de Refração ηd
1.3611
Usos de álcool etílico
 Um dos usos mais comuns do álcool é como anti -séptico
Um dos usos mais comuns do álcool é como anti -séptico Usos médicos
Antisséptico
O etanol é usado como anti -séptico, pois tem uma ação letal contra bactérias e fungos. É capaz de alterar a estrutura de suas membranas plasmáticas, que produz sua destruição através dos fluxos de água osmótica que são estabelecidos.
Da mesma forma, o etanol pode destruir muitos tipos de vírus. Atualmente, o uso de géis que contêm álcool para desinfetar as mãos e reduzir o contágio com o coronavírus é recomendado. O etanol também é usado na desinfecção de feridas menores superficiais.
Solvente de drogas
Muitos medicamentos são pouco solúveis em água, usando etanol para aumentar sua solubilidade. Algumas tetas para lavagens de tosse e boca têm um contempido de etanol de até 25%.
Tratamento da dor
O etanol é usado para a lise terapêutica de nervos ou gânglios para o alívio da dor intratável crônica, presente em câncer inoperável ou em uma neuralgia do trigêmeo.
Tratamento sintomático dos cistos da tireóide
As injeções percutâneas de etanol são usadas no tratamento de cistos da tireóide, um procedimento simples que pode evitar complicações da intervenção cirúrgica.
Ação sedativa
Ocasionalmente, o etanol é administrado por via intravenosa para sedação pré -operatória e pós -operatória, naqueles pacientes a quem outras medidas não são utilizáveis.
Antídoto
O etanol é usado sistêmico para o tratamento de envenenamento com metanol ou etileno glicol.
Glaucoma
O etanol é usado para reduzir a pressão intra -ocular em pacientes com glaucoma.
Combustível
Estados Unidos, juntamente com o Brasil, consome 90% do etanol usado como combustível em carros. Os Estados Unidos são o maior produtor de milho do mundo, por isso usa milho como fonte de etanol como combustível.
O governo subsidiou os produtores de milho, que aumentaram entre 1979 e 1986 a produção de etanol combustível de 20 milhões de galões por ano para 750 milhões de galões.
A cana -de -açúcar é a principal fonte de etanol no Brasil para uso como combustível. Em 1943, devido à Segunda Guerra Mundial.
Pode atendê -lo: DeutérioDesde 1976, eles são usados como combustível nas misturas de carros de etanol e gasolina, cujo conteúdo de etanol varia entre 10 e 25 %, dependendo da produção de cana -de -açúcar.
Uso recreativo
O etanol está presente em inúmeras bebidas usadas em reuniões sociais e até durante o almoço e jantar em família.
A ação inicial do álcool para desinibir o comportamento social da pessoa produz um ambiente agradável e facilitador da interação entre as pessoas. No entanto, o excesso de etanol pode detonar efeitos tóxicos e indesejáveis na saúde pessoal e em harmonia entre reuniões ou eventos.
Cuidado pessoal
O etanol está presente em muitos produtos de cosméticos e beleza. Além. Também faz parte da preparação de muitas loções e perfumes.
Comida
A essência da baunilha, um sabor de uso em bolos e bolos, é dissolvido em uma mistura de etanol e água. Os doces cheios de certas bebidas alcoólicas são vendidas. O álcool também é usado como um gosto de alguns doces.
Obtendo álcool etílico
O etanol é obtido principalmente por fermentação de açúcar e hidratação de etileno, ensaiando para produzi -lo a partir de dióxido de carbono, lipídios e celulose.
Fermentação
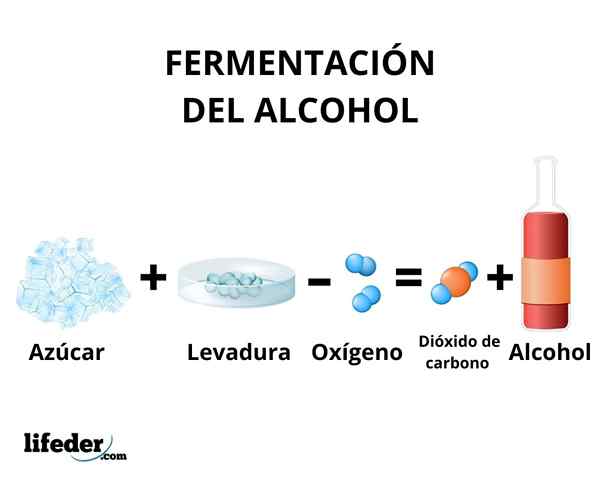
No processo de fermentação, a transformação de carboidratos em etanol ocorre pela ação das enzimas presentes na levedura. Principalmente, cana de açúcar, beterraba e cereais como milho e cevada são usados como matéria -prima.
As enzimas da glicólise de algumas espécies de leveduras, como Saccharomyces cerevisiae, Eles são capazes de agir com glicose e sacarose açúcares, a fim de produzir etanol. A concentração de etanol produzida é limitada pela suscetibilidade de leveduras ao etanol.
De qualquer forma, a concentração de etanol produzida pela fermentação não excede 18%. É necessário concentrar a solução de etanol usando a destilação simples. Através deste método, uma solução de etanol é obtida com uma concentração em torno de 95%.
Finalmente, destilação fracionada e desidratação de álcool a 95% para produção absoluta de álcool são usados. O etanol produzido pela fermentação é usado na medicina e é reservado como um combustível que complementa a gasolina.
Hidratação de etileno
Nesse processo, o etileno é misturado com altas temperaturas com vapor desionizado a altas temperaturas, entre 250 e 300 ° C, e sob uma pressão de 6.8 MPa. A conversão do etileno em etanol é catalisada por ácido fosfórico colocado em uma sílica ou diatomácea no leito terrestre.
Pode atendê -lo: propriedades mecânicas de metaisA reação de hidratação de etileno pode ser esquematizada da seguinte forma:
C2H4 + H2O → CH3CH2Oh
Parte do ácido fosfórico é arrastado pelo vapor de água e deve ser neutralizado com hidróxido de sódio diluído. A concentração de etanol obtida por hidratação de etileno é baixa, com um valor entre 10 e 25%.
Em seguida, a solução de etanol é concentrada por destilação, obtendo uma solução de etanol de 95%, que pode ser realizada 100% por destilação fracionária e desidratação.
Outros métodos
A partir de métodos alternativos para a produção de etanol, temos o uso de dióxido de carbono, lipídios e celulose. O uso de celulose é mais promissor, uma vez que materiais como madeira, palha, resíduos, etc., Como fonte de matéria -prima de celulose. A celulose é um polímero de glicose e pode ser usada como fonte desse carboidrato.
Toxicidade e riscos
 Barcos de álcool caseiros geralmente são encontrados em uma concentração de 70%a 90%
Barcos de álcool caseiros geralmente são encontrados em uma concentração de 70%a 90% Inalação
Altas concentrações de vapor de etanol podem causar sonolência, irritação ocular e trato respiratório superior, manifestado por tosse e dor de cabeça.
Contato direto com a pele e os olhos
O contato da pele pode causar secura e, crônica, irritação e dermatite. Enquanto isso, o contato visual produz irritação, vermelhidão, dor e sensação de queima.
Ingestão
Produz uma sensação de queimação e, a princípio, tem uma ação estimulante e agradável devido à desinibição produzida. Mas quando a ingestão de álcool continua, há uma depressão nervosa, dor de cabeça, visão turva, sonolência e inconsciência.
Efeitos crônicos
O etanol afeta o sistema nervoso central e o trato respiratório superior. Além disso, os danos no fígado causados pela ingestão de etanol podem levar à cirrose e, posteriormente, morte.
Referências
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. (10º Edição.). Wiley Plus.
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Morrison e Boyd. (1987). Quimica Organica. (Quinta edição). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Etanol. Recuperado de: em.Wikipedia.org
- Centro Nacional de Informações sobre Biotecnologia. (2020). Etanol. Resumo do PubChem Comunund para CID 702. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- História do etanol. (2011). História do etanol - do álcool ao combustível de carro. Recuperado de: etanolistoria.com
- Os editores da Enyclopaedia Britannica. (2020). Etanol. Recuperado de: Britannica.com
- Corquiven. (15 de outubro de 2000). Folha de segurança (MSDS) Álcool Etílico. [PDF]. Recuperado de: iio.ENS.UABC.mx
- Byju's. (2020). Usos de metanol e etanol. Recuperado de: byjus.com
- Helmestine, Anne Marie, Ph.D. (25 de agosto de 2020). A diferença entre álcool e etanol. Recuperado de: pensamento.com

