Agente de redução conceitual, os exemplos mais fortes,

- 2852
- 753
- Ernesto Bruen
A agente redutor É uma substância que cumpre a função de reduzir um agente oxidante em uma reação de redução de óxido. Agentes redutores são doadores de elétrons por natureza, geralmente substâncias que estão nos níveis mais baixos de oxidação e com uma alta quantidade de elétrons.
Há uma reação química na qual os estados de oxidação dos átomos variam. Essas reações envolvem um processo de redução e oxidação complementar. Nessas reações, um ou mais elétrons de uma molécula, átomo ou íons são transferidos para outra molécula, átomo ou íon. Isso implica a produção de uma reação de redução de óxido.

Durante o processo de redução de óxido, esse elemento ou composto que perde (ou dona) seu elétron (ou elétrons) é chamado de agente redutor, contrastando com esse agente oxidante que é o receptor de elétrons. Dizem então que os agentes redutores reduzem o agente oxidante e que o agente oxidante oxida o agente redutor.
Os melhores ou mais fortes agentes redutores são aqueles que têm o maior rádio atômico; ou seja, eles têm uma distância maior de seu núcleo até os elétrons que cercam o mesmo.
Agentes redutores são geralmente íons metal ou negativos. Entre os agentes redutores comuns estão o ácido ascórbico, enxofre, hidrogênio, ferro, lítio, magnésio, manganês, potássio, sódio, vitamina C, zinco e até extrato de cenoura.
[TOC]
O que está redutor de agentes?
Como já foi dito, os agentes redutores são responsáveis por diminuir um agente oxidante quando ocorre uma reação de redução de óxido.
Uma reação simples e típica da reação de redução de óxido é a da respiração celular aeróbica:
Pode servir a você: hidreto de alumínio (ALH3): estrutura, propriedades, usosC6H12QUALQUER6(s) + 6o2(g) → 6co2(g) + 6h2Ou (l)
Nesse caso, onde glicose (c6H12QUALQUER6) está reagindo com oxigênio (ou2), a glicose está se comportando como o agente redutor para dar elétrons ao oxigênio - ou seja, está sendo oxidado - e o oxigênio se torna um agente oxidante.
Na química orgânica, os melhores agentes redutores são considerados reagentes que fornecem hidrogênio (h2) para a reação. Nesse campo da química, a reação de redução refere-se à adição de hidrogênio a uma molécula, embora a definição anterior (reações de redução de óxido também se apliquem.
Fatores que determinam a força de um agente redutor
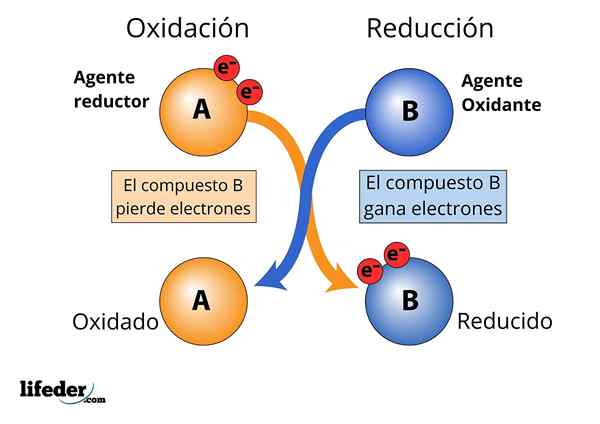 Agente oxidante e redutor, perda e ganho de elétrons são observados
Agente oxidante e redutor, perda e ganho de elétrons são observados Para que uma substância seja considerada "forte".
Para isso, existem vários fatores que devem ser levados em consideração para reconhecer a força que um agente redutor pode ter: eletronegatividade, raio atômico, energia de ionização e potencial de redução.
Eletro-negatividade
Eletronegatividade é a propriedade que descreve a tendência de um átomo de atrair alguns elétrons unidos em sua direção. A maior eletronegatividade, quanto maior a força de atração exercida pelo átomo sobre os elétrons circundantes.
Na tabela periódica, a eletronegatividade aumenta da esquerda para a direita, de modo que os metais alcalinos são os elementos menos eletronegativos.
Rádio atômico
É a propriedade que mede a quantidade de átomos. Refere -se à distância típica ou média do centro de um núcleo atômico até a fronteira da nuvem eletrônica que a rodeia.
Pode atendê -lo: nitritos: propriedades, estrutura, nomenclatura, formaçãoEssa propriedade não é precisa - além disso, várias forças eletromagnéticas estão envolvidas em sua definição - mas sabe -se que esse valor está diminuindo da esquerda para a direita na tabela periódica e aumentando de cima para baixo. É por isso que os metais alcalinos, especialmente o césio, são considerados de maior rádio atômico.
Energia de ionização
Esta propriedade é definida como a energia necessária para remover o elétron menos unido de um átomo (o Valencia Electron) para formar um cátion.
Dizem que quanto mais próximos os elétrons estiverem do núcleo do átomo em torno, maior a energia de ionização do átomo.
A energia de ionização aumenta a partir da esquerda da direita e de baixo para cima na tabela periódica. Novamente, os metais (especialmente alcalinos) têm menos energia de ionização.
Potencial de redução
É a medida da tendência de uma espécie química obter elétrons e, portanto, ser reduzida. Cada espécie tem um potencial de redução intrínseca: quanto maior o potencial, maior a afinidade dela com elétrons e também sua capacidade de ser reduzida.
Agentes redutores são aquelas substâncias com menos potencial de redução, devido à sua pouca afinidade com os elétrons.
Agentes redutores mais fortes
Com os fatores descritos acima, pode -se concluir que, para encontrar um agente redutor "forte", um átomo ou molécula com baixa eletronegatividade, alto raio atômico e baixa energia de ionização é desejado.
Como já mencionado, os metais alcalinos apresentam essas características e são considerados os agentes redutores mais fortes.
Pode servir a você: hidrocarbonetos alifáticos: propriedades, nomenclatura, reações, tiposPor outro lado, o lítio (LI) é considerado o agente redutor mais forte a ter o menor potencial de redução, enquanto a molécula Lialh4 É considerado o agente redutor mais forte de todos, para conter isso e as outras características desejadas.
Exemplos de reações com agentes redutores
Existem muitos casos de redução de óxido na vida cotidiana. Abaixo estão alguns dos mais representativos:
Exemplo 1
A reação de combustão do octano (o principal componente da gasolina):
2 c8H18(l) + 25o2 → 16CO2(g) + 18h2O (G)
Você pode ver como o octano (agente redutor) dona oxigênio elétrons (agente oxidante), formando dióxido de carbono e água em grandes quantidades.
Exemplo 2
A hidrólise da glicose é outro exemplo útil de uma redução comum:
C6H12QUALQUER6 + 2AdP + 2p + 2nad+ → 2CH3COCO2H + 2ATP + 2NADH
Nesta reação, as moléculas NAD (um receptor de elétrons e agente oxidante nesta reação) tomam elétrons de glicose (agente redutor).
Exemplo 3
Finalmente, na reação do óxido férrico
Fé2QUALQUER3(s) + 2al (s) → para2QUALQUER3(s) + 2fe (l)
O agente redutor é o alumínio, enquanto o agente oxidante é ferro.
Referências
- Wikipedia. (s.F.). Wikipedia. Obtido de in.Wikipedia.org
- BBC. (s.F.). BBC.co.Reino Unido. Obtido da BBC.co.Reino Unido
- Pearson, d. (s.F.). Química Librettexts. Obtido da Chem.Librettexts.org
- Pesquisa, b. (s.F.). Bodner Research Web. Obtido de murmúrio.Chem.Purdue.Edu
- Peter Atkins, L. J. (2012). Princípios químicos: a busca pelo insight.
- « Cassia angustifolia Propriedades, preparação, contra -indicações
- Características azimutais de projeção, tipos, vantagens, desvantagens »

