Estrutura isoamilo, propriedades, síntese e usa acetato

- 4269
- 1290
- Ralph Kohler
Ele Acetato de isoamilo É um éster cuja fórmula molecular é Cho3COO (cap2)2Ch (cap3)2. À temperatura ambiente, consiste em um fluido oleoso, claro, incolor, inflamável e volátil. De fato, é um éster muito volátil e perfumado.
Sua principal característica é dizer adeus a um cheiro que contribui para o aroma de muitas frutas, especialmente a de bananas ou banana. Além disso, esta última fruta constitui uma de suas fontes naturais por excelência.
 Bananas, cujo aroma característico é devido ao acetato de isoamilo. Fonte: Pixabay.
Bananas, cujo aroma característico é devido ao acetato de isoamilo. Fonte: Pixabay. A partir daí, o nome do óleo de banana que é dado a uma solução de acetato de isoamil ou uma mistura de acetato de isomil com nitrocelulose. O composto é amplamente utilizado como um sabor de comida, sorvete e doces.
Além disso, é usado na elaboração de fragrâncias com diferentes empregos. É também um solvente usado na extração de metais e compostos orgânicos, como o ácido acético.
O acetato de isoamilo é o resultado da esterificação de álcool isoamílico com ácido acético. Nos laboratórios de ensino de química orgânica, essa síntese representa uma experiência interessante para implementar a esterificação, enquanto inundava o laboratório com fragrância de banana.
[TOC]
Estrutura de acetato de isoamilo
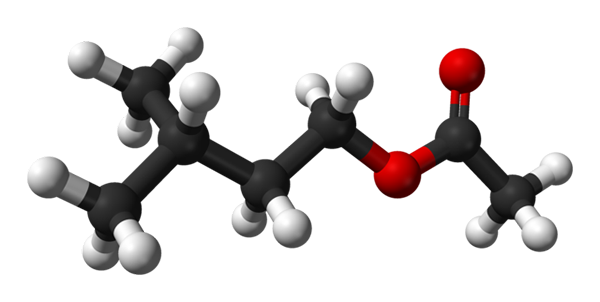 Estrutura de acetato de isoamilo. Fonte: Ben Mills [domínio público]
Estrutura de acetato de isoamilo. Fonte: Ben Mills [domínio público] Na imagem superior, você tem a estrutura molecular do acetato de isoamil por meio de um modelo de esferas e barras. As esferas vermelhas correspondem a átomos de oxigênio, especificamente aqueles que identificam esse composto como um éster; sua parte do éter, r-o-r, e o grupo carbonil, c = o, depois tendo a fórmula estrutural r'Coor.
À esquerda, r', Você tem o radical alquídico isopentil (CHO3)2Chch2CH2; E à direita, r, para o grupo metil, ao qual o 'acetato' do nome deste éster é devido. É um éster relativamente pequeno, capaz de interagir com os receptores químicos do cheiro de nossos narizes, causando sinais de que o cérebro interpreta como uma fragrância.
Pode atendê -lo: alcanes ramificadosInterações intermoleculares
A própria molécula de acetato de isoamil é flexível; Porém, o radical isopentil não beneficia interações intermoleculares porque é ramificada, impedindo estericamente os átomos de oxigênio interagirem com eficiência pelas forças dipolo-dipolo.
Além disso, esses dois oxigênio não podem aceitar pontes de hidrogênio; Estruturalmente, a molécula não tem como doá -los. Diante dos dipolos interrompidos, o acetato de isoamil pode interagir intermolecularmente através das forças de dispersão de Londres; que são diretamente proporcionais à sua massa molecular.
Assim, é a massa molecular do éster responsável por suas moléculas para formar um líquido com um ponto de ebulição alto (141 ° C). Da mesma forma, é responsável por sua cobertura sólida para uma temperatura de -78 ° C.
Fragrância de banana
Suas forças intermoleculares são tão fracas que o líquido é volátil o suficiente para permear seus arredores com cheiros de bananas. Curiosamente, o cheiro doce deste éster pode mudar se o número de carbonos for reduzido ou aumentado.
Ou seja, se, em vez de ter seis carbonos alifáticos, ele tinha cinco (com o Isobutil Radical), seu cheiro se parecerá com o de framboesas; Se os radicais fossem o Secbutil, o cheiro seria carregado com traços de solventes orgânicos; E se eu tivesse mais de seis carbonos, o cheiro começaria a se tornar sabão e metálico.
Propriedades
Nomes químicos
-Acetato de isoamilo
-Etanoato isopentil
-Acetato de 3-metilbutilo
-Acetato de isopentilo
-Óleo de banana ou banana.
Fórmula molecular
C7H14QUALQUER2 ou cap3COO (cap2)2Ch (cap3)2
Peso molecular
130.187 g/mol.
Descrição física
É um líquido oleoso, claro e incolor.
Cheiro
À temperatura ambiente, tem um cheiro intenso e agradável de banana.
Sabor
Tem um sabor semelhante ao apresentado pela pêra e maçã.
Ponto de ebulição
124,5 ºC.
Ponto de fusão
-78,5 ºC.
ponto de ignição
92 ºF de xícara fechada (33 ºC); Copo aberto 100 ºF (38 ºC).
Pode servir a você: sólidos cristalinos: estrutura, propriedades, tipos, exemplosSolubilidade em água
2.000 mg/l a 25 ºC.
Solubilidade em solventes orgânicos
Miscível com álcool, éter, acetato de etila e álcool amílico.
Densidade
0,876 g/cm3.
Densidade do vapor
4.49 (no relacionamento aéreo = 1).
Pressão de vapor
5,6 mmHg a 25 ºC.
Temperatura de auto -ignição
680 ºF (360 ºC).
Gosma
-1.03 CPOISE a 8,97 ºC
-0,872 CPOISE em 19,91 ºC.
Calor de combustão
8.000 cal/g.
Limiar de cheiro
Ar = 0,025 µl/L
Água = 0,017 mg/l.
Índice de refração
1.400 a 20 ° C.
Velocidade de evaporação relativa
0,42 (em relação ao acetato de butil = 1).
Constante dialétrica
4,72 a 20 ºC.
Armazenar
O acetato de isoamilo é um composto inflamável e volátil. Portanto, deve estar frio em recipientes completamente herméticos, longe de ser substâncias combustíveis.
Síntese
É produzido pela esterificação de álcool isoamílico com ácido acético glacial, em um processo conhecido como estterificação de Fisher. O ácido sulfúrico é geralmente usado como catalisador, mas também o ácido p-toluenossulfônico catalisa a reação:
(CH3)2CH-CH2-CH2CH2Oh + ch3COOH => CH3Cooch2-CH2-CH2-Ch (cap3)2
Formulários
Comida e bebida aromatizando
É usado para conferir um sabor de pêra em água e xaropes. É usado na China para preparar sabores de frutas, como morango, amora, abacaxi, pêra, maçã, uva e banana. As doses usadas são: 190 mg/kg na confeitaria; 120 mg/kg em massa; 56 mg/kg em sorvete; e 28 mg/kg em refrigerantes.
Solvente e diluente
É um solvente para:
-Nitrocelulose e celulóide
-Vernis à prova d'água
-Éster borracha
-Resina de vinil
-Resina Cummarona e óleo de mamona.
É usado como solvente para determinação do cromo e é usado como um agente de extração de ferro, cobalto e níquel. Também é usado como solvente de pinturas a óleo e lacas antigas. Além disso, é usado na elaboração de esmalte.
Este éster é usado como diluente na produção de ácido acético. O óleo é usado como matéria -prima em um processo de oxidação que produz uma solução aquosa de ácido acético e outros compostos, como ácido fórmico e ácido propiônico.
Pode atendê -lo: etileno glicol: propriedades, estrutura química, usosComo solvente e portador de outras substâncias, foi usado no início da indústria aeronáutica para proteger os tecidos das asas aéreas.
Fragrâncias
-É usado como uma atmosfera para encobrir os cheiros maus.
-É usado como um perfume em sapatos.
-Para provar a eficiência das máscaras antigase, já que o acetato de isoamil tem um limiar de cheiro muito baixo e não é muito tóxico.
-É usado em fragrâncias como Chipre; o aroma macio Osmanthus; O jacinto; e o forte sabor oriental, usado em doses baixas, inferior a 1%.
Outros
É usado na elaboração de seda e pérolas artificiais, filmes fotográficos, vernizes à prova d'água e bronzeador. Também é usado na indústria têxtil no tingimento e acabamento. É usado na lavagem a seco de itens de vestido e móveis de pano.
Além disso, o acetato de isoamilo é usado na elaboração do rayon, um tecido sintético; Na extração de penicilina e como uma substância de cromatografia padrão.
Riscos
O acetato de isoamilo pode irritar a pele e os olhos pelo contato físico. A inalação pode causar irritação no nariz, garganta e pulmões. Enquanto isso, a exposição a altas concentrações pode causar dor de cabeça, sonolência, vertigem, tontura, fadiga e desmaio.
O contato prolongado com a pele pode causar sua secura e rachaduras.
Referências
- Bilbrey Jenna. (30 de julho de 2014). Acetato de isoamil. Química World pela Royal Society of Chemistry. Recuperado de: químicaworld.com
- Centro Nacional de Informações sobre Biotecnologia. (2019). Acetato de isoamil. Banco de dados PubChem. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Wikipedia. (2019). Acetato de isoamil. Recuperado de: em.Wikipedia.org
- Sociedade Real de Química. (2015). Acetato de isoamil. Chemspider. Recuperado de: chemspider.com
- Departamento de Saúde de Nova Jersey e Serviços Sênior. (2005). Acetato de isoamil. [PDF]. Recuperado de: NJ.Gov
- Livro químico. (2017). Acetato de isoamil. Recuperado de: ChemicalBook.com
- « 4 períodos de química da pré -história até hoje
- Características políticas de fala, tipos, questões e exemplos »

