Óxido de potássio (K2O)
- 1260
- 279
- Alfred Kub
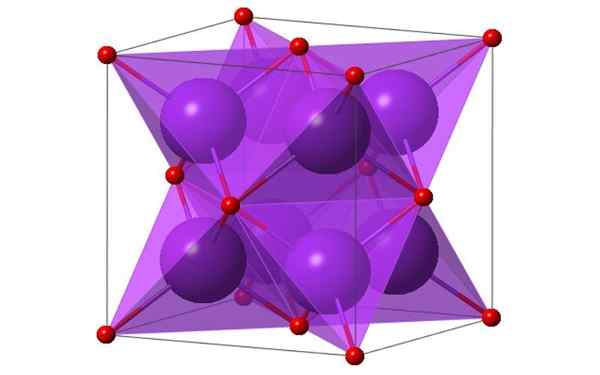
 Projeto cúbico de 4 moléculas de óxido de potássio. Fonte: Ktlabe, Wikimedia Commons
Projeto cúbico de 4 moléculas de óxido de potássio. Fonte: Ktlabe, Wikimedia Commons O que é óxido de potássio?
Ele óxido de potássio, Também chamado de óxido de dipotasium, é um oxigênio iônico e sal de potássio, com fórmula k2QUALQUER. É o óxido de potássio mais simples, altamente reativo e raramente encontrado. Alguns materiais comerciais, como fertilizantes e cimento2QUALQUER.
O óxido de potássio é produzido a partir de hidróxido de potássio (potassa cáustica) e 450 ° C de potássio metálico, produzindo hidrogênio molecular de acordo com a equação:
2k + 2koh ⇌ 2k2Ou + h2 (450 ° C).
Também é obtido reduzindo o peróxido de potássio de acordo com a reação:
2k2QUALQUER2 → k2Ou + o2 (530 ° C).
Outro método de obtenção de óxido de potássio é aquecendo o carbonato de potássio em alta temperatura, conforme indicado pela seguinte reação:
K2Co3 ⇌ k2O + CO₂ (T> 1200 ° C).
No entanto, a principal maneira de obter óxido de potássio é pelo aquecimento do nitrato de potássio, obtendo nitrogênio molecular, conforme indicado pela seguinte reação:
2kno3 + 10k → 6k2Ou + n2
Propriedades físicas e químicas
- Eles são cristais tetraédricos, amarelados, sem aroma característico.
- Tem um peso molecular de 94,2 g/mol e uma densidade de 2,13 g/ml a 24 ° C.
- Possui um ponto de fusão de 740 ° C, embora comece a se decompor a 300 ° C.
- É resistente ao calor e solúvel em etanol e éter. K2Ou cristalizar na estrutura antifluorita. Por esse motivo, as posições dos ânions e cátions são investidos em relação às suas posições no CAF2, com íons de potássio coordenados a 4 íons de íons de óxido e óxido coordenados em 8 potássio.
- É um óxido básico e reage violentamente com a água para produzir hidróxido de potássio cáustico. É delicado e absorve a água da atmosfera, começando esta reação vigorosa.
Pode servir a você: nitrato de cálcio (CA (NO3) 2)- Oxida -se reversivelmente ao peróxido de potássio a 350 ° C, reage violentamente com ácidos, como o ácido clorídrico, para formar sais de potássio de acordo com a reação:
K2O + 2HCL → 2KCL + H₂O.
- Reage com dióxido de nitrogênio para formar nitrato de nitrato e potássio a temperaturas entre 150 e 200 ° C:
K2O + 2no2 = KNO2 + Kno3
- Reaja a baixas temperaturas com amônia para formar amidas e hidróxido de potássio de acordo com a reação:
K2O + NH3 (L) → KNH2↓ + koh (-50 ° C).
Riscos
O óxido de potássio é uma substância instável. Oxida facilmente outros óxidos de potássio, peróxido ou ácido de potássio (KHO) (KHO). O composto não é combustível, mas reage vigorosamente e exotermicamente com água para formar hidróxido de potássio (KOH).
A solução de óxido de potássio na água é uma base forte, reage violentamente com ácido e é corrosivo. Reage violentamente com água que produz hidróxido de potássio. Ataca muitos metais na presença de água.
A substância é corrosiva para olhos, pele e vias aéreas, bem como por ingerir. A inalação de aerossol pode causar edema pulmonar, cujos sintomas geralmente se manifestam após algumas horas e são agravados pelo esforço físico.
Em caso de contato visual, você deve verificar se as lentes de contato estão sendo usadas e removê -las imediatamente. Os olhos devem ser lavados com água corrente por pelo menos 15 minutos, com pálpebras abertas. Água fria pode ser usada, e não uma pomada olho.
Se o produto químico entrar em contato com as roupas, retire -as o mais rápido possível, protegendo suas próprias mãos e corpo. Coloque a vítima sob um chuveiro de segurança.
Se o produto químico se acumular na pele exposta, como as mãos, a pele contaminada com água corrente e sabonete não abrasivo é suavemente lavado e cuidadosamente. Água fria pode ser usada. Se a irritação persistir, procure atendimento médico. Lave roupas contaminadas antes de usá -las novamente.
Pode servir a você: Rubidio: História, Propriedades, Estrutura, Obtenção, UsosSe o contato da pele for grave, ele deve ser lavado com um sabão desinfetante e cobrir a pele contaminada com um creme antibacteriano.
Em caso de inalação, a vítima deve permanecer em uma área bem ventilada. Se a inalação for grave, a vítima deve ser evacuada para uma área segura o mais rápido possível.
Solte roupas apertadas, como pescoços de camisa, cintos ou gravata. Se a vítima é difícil de respirar, o oxigênio deve ser administrado. Se a vítima não está respirando, uma ressuscitação na boca é feita.
Sempre levando em consideração que pode ser perigoso para a pessoa que fornece ajuda para dar a ressuscitação boca a boca quando o material inalado é tóxico, infeccioso ou corrosivo.
Em caso de ingestão, não induz vômito. Solte as roupas apertadas. Em todos os casos, deve -se procurar atenção médica imediata.
Formulários
- A fórmula química k2Ou (ou simplesmente k) é usado em vários contextos industriais: números n-p-k para fertilizantes, fórmulas de cimento e fórmulas de vidro.
Muitas vezes, não é usado diretamente nesses produtos, mas a quantidade de potássio é relatada em termos de k equivalente2Ou para qualquer tipo de composto de potássio utilizado, como carbonato de potássio.
- O óxido de potássio é de aproximadamente 83% do potássio em peso, enquanto o cloreto de potássio é de apenas 52%. O cloreto de potássio fornece menos potássio do que uma quantidade igual de óxido de potássio.
Portanto, se um fertilizante for 30% de cloreto de potássio em peso, seu índice padrão de potássio, baseado em óxido de potássio, seria de apenas 18,8%. É fabricado e/ou entre 10 e 100 toneladas por ano desta substância no espaço econômico europeu.
Pode atendê -lo: Química na vida cotidiana: +30 exemplos- Esta substância é usada em produtos químicos de laboratório, fertilizantes, polímeros e produtos fitossanitários. O K2O tem um uso industrial que resulta na fabricação de outra substância (uso de produtos intermediários).
- O óxido de potássio é usado nas áreas de mistura e/ou agricultura, formulação de silvicultura e pesca. É usado para a fabricação de produtos químicos, produtos plásticos e produtos minerais (por exemplo, gesso, cimento).
- É usado ao ar livre em materiais de longo prazo com liberação de baixa velocidade, por exemplo, materiais de construção de metal, madeira e plástico.
- Materiais internos e longo -são usados com velocidade de baixa liberação, como móveis, brinquedos, materiais de construção, cortinas, calçados, produtos de couro, produtos de papel e papelão, equipamentos eletrônicos.
- Esta substância pode ser encontrada em produtos com material à base de pedra, gesso, cimento, vidro ou cerâmica (por exemplo, pratos, panelas / panelas, recipientes de armazenamento de alimentos, material de construção e isolamento).
- O óxido de potássio é uma fonte termicamente estável e altamente insolúvel, adequada para aplicações de vidro, óptica e cerâmica. Os compostos de óxido não conduzem eletricidade.
- Também é usado em componentes estruturais leves em aplicações aeroespaciais e eletroquímicas, como baterias de combustível nas quais a condutividade iônica exibe.
Referências
- Elementos americanos (S.F.). Óxido de potássio. Recuperado dos americanos.com.
- Óxido de dipassium. Recuperado do ECHA.Europa.UE.

