Óxido de lítio
- 1304
- 111
- Shawn Leffler
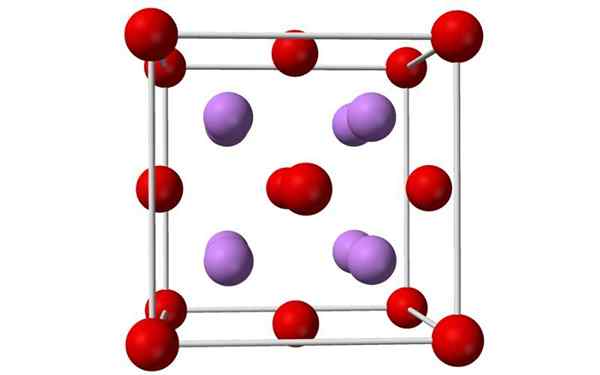
 Modelo de esferas e barras de uma célula unitária de óxido de lítio. Fonte: Benjah-BMM27, Wikimedia Commons
Modelo de esferas e barras de uma célula unitária de óxido de lítio. Fonte: Benjah-BMM27, Wikimedia Commons O que é óxido de lítio?
Ele Óxido de lítio É um composto químico inorgânico da fórmula li2Ou que é formado junto com pequenas quantidades de peróxido de lítio quando o metal de lítio é queimado no ar e combina com oxigênio.
Até os anos 90, o mercado de metal e lítio era dominado pela produção dos EUA a partir de depósitos minerais, mas no início do século 21 a maior parte da produção foi derivada de outras fontes: Austrália, Chile e Portugal eram os fornecedores mais importantes do mundo. A Bolívia tem metade dos depósitos de lítio no mundo, mas não é um grande produtor.
A forma comercial mais importante é o carbonato de lítio, li2Co3, produzido a partir de minerais ou salmuelas por vários processos diferentes.
Quando o lítio queima no ar, o produto principal é o óxido de lítio branco, li2QUALQUER. Além disso, ocorre algum peróxido de lítio, li2QUALQUER2, Também branco.
Isso também pode ser feito através da decomposição térmica de hidróxido de lítio, lioh ou peróxido de lítio, li2QUALQUER2.
4li (s) + o2(g) → 2li2Você)
2lioh (s) + calor → li2Ou (s) + h₂o (g)
2li2QUALQUER2(s) + calor → 2li2Ou (s) + ou2(g)
Propriedades físicas e químicas
- O óxido de lítio é um sólido branco conhecido como Lithia, que não tem aroma e tem sabor salgado.
- O óxido de lítio são cristais com geometria de antiflorito, semelhante ao cloreto de sódio (cúbico centrado em faces).
- Seu peso molecular é de 29,88 g/mol, sua densidade é de 2.013 g/ml e os pontos de fusão e ebulição são 1438 ° C e 2066 ° C, respectivamente.
Pode servir você: epid- O composto é muito solúvel em água, álcool, éter, piridina e nitrobenzeno.
- O óxido de lítio reage facilmente com o vapor de água para formar hidróxido e dióxido de carbono para formar carbonato; Portanto, deve ser armazenado e gerenciado em uma atmosfera limpa e seca.
- Os compostos de óxido não conduzem eletricidade. No entanto, certos óxidos estruturados de perovskita são condutores eletrônicos que encontram aplicação no cátodo de células a combustível de óxido sólido e sistemas de geração de oxigênio.
- São compostos que contêm pelo menos um ânion de oxigênio e um cátion metálico.
Riscos
O óxido de lítio é um composto estável incompatível com ácidos fortes, água e dióxido de carbono. Até onde sabemos, as propriedades químicas, físicas e toxicológicas do óxido de lítio não foram investigadas e relatadas minuciosamente.
A toxicidade dos compostos de lítio é uma função de sua solubilidade na água. O íon de lítio tem toxicidade no sistema nervoso central. O composto é altamente corrosivo, irritante se entrar em contato com os olhos e a pele, quando inalado ou ingerido.
Em caso de contato visual, você deve verificar se as lentes de contato estão sendo usadas e removê -las imediatamente. Eles devem ser lavados com água corrente por pelo menos 15 minutos, mantendo as pálpebras abertas. Água fria pode ser usada, e não uma pomada olho.
Se o produto químico entrar em contato com as roupas, retire -as o mais rápido possível, protegendo suas próprias mãos e corpo. Coloque a vítima sob um chuveiro de segurança.
Se o produto químico se acumular na pele exposta da vítima, como as mãos, a pele contaminada com água corrente e sabão não abrasivo é suavemente lavado e cuidadosamente. Água fria pode ser usada. Se a irritação persistir, procure atendimento médico. Lave roupas contaminadas antes de usá -las novamente.
Pode servir a você: Rankine Scale: O que é, conversões, exemplosEm caso de inalação, a vítima deve permanecer em uma área bem ventilada. Se a inalação for grave, a vítima deve ser evacuada para uma área segura o mais rápido possível.
Solte roupas apertadas, como pescoços de camisa, cintos ou gravata. Se a vítima é difícil de respirar, o oxigênio deve ser administrado. Se a vítima não está respirando, uma ressuscitação na boca é feita.
Sempre levando em consideração que pode ser perigoso para a pessoa que fornece ajuda para dar a ressuscitação boca a boca quando o material inalado é tóxico, infeccioso ou corrosivo. Em todos os casos, deve -se procurar atenção médica imediata.
Formulários
- O óxido de lítio é usado como fundador em esmaltes de cerâmica e cria azul com cobre e rosas com cobalto. Reage com água e vapor, formando hidróxido de lítio e deve ser isolado deles.
- Óxido de lítio (Li2O), com seu alto potencial Tritio, é um candidato atraente para o material sólido de cultivo de uma planta de energia de fusão DT, devido à sua alta densidade de átomos de lítio (em comparação com outros lítio ou cerâmica de lítio metálico) e sua condutividade térmica relativamente alta.
Li2O será exposto a altas temperaturas sob irradiação de nêutrons durante a operação de cobertores de fusão. Nessas circunstâncias, um grande número de defeitos de irradiação será produzido em Li2Ou, como inchaço induzido por hélio, expansão térmica relativamente alta, crescimento de grãos, formação e precipitação de LYH (t) a baixas temperaturas e transporte de massa liOH (t) a altas temperaturas.
Além disso, o LI2Ou estará sujeito a tensões que surgem das diferenças de expansão térmica entre Li2O e materiais estruturais. Essas características de Li2Ou levar a problemas desafiadores de engenharia, tanto na fabricação quanto no design de Manta.
Pode atendê -lo: hidreto de estrôncio (SRH2)- Um possível novo uso é como um substituto para o cobalto e o óxido de lítio, como o cátodo em baterias de lítio usadas para aumentar os dispositivos de telefone celular eletrônico em laptops, bem como carros com baterias.
Referências
- Elementos americanos. Óxido de lítio. Recuperado dos americanos americanos.com.
- Óxido de lítio. Recuperado de espimetals espimetais.com.
- Óxido de lítio (LI2O). FERP recuperado.Ucsd.Edup Ferp.Ucsd.Edu.

