Óxido de ferro

- 2049
- 317
- Tim Mann
 O óxido de ferro é um composto químico entre ferro e oxigênio
O óxido de ferro é um composto químico entre ferro e oxigênio O que é óxido de ferro?
Ele óxido de ferro É algum dos compostos formados entre ferro e oxigênio. Eles são caracterizados por serem iônicos e cristalinos, e estão espalhados como resultado da erosão de seus minerais, compondo solos, massa vegetal e até o interior dos organismos vivos.
É uma das famílias de compostos que predominam na crosta terrestre. Os óxidos de ferro são conhecidos até o momento, sendo a maioria de origem natural e outros sintetizados sob condições extremas de pressão ou temperatura.
Na imagem superior, é mostrada uma porção de pó de óxido férrico. Sua característica cor vermelha cobre o ferro de vários elementos arquitetônicos no que é conhecido como ferrugem. Da mesma forma, é observado nas encostas, montanhas ou solos, misturadas com muitos outros minerais, como a poeira amarela da goethita (α-feooh).
Os óxidos de ferro mais conhecidos são hematita (α-FE2QUALQUER3) e Maghemita (fé2QUALQUER3), ambos os polimorfos de óxido férrico; E não menos importante, magnetita (fé3QUALQUER4).
Suas estruturas polimórficas e sua grande área superficial são feitas por materiais interessantes, como sorventes ou para a síntese de nanopartículas com aplicações amplas.
Estrutura dos óxidos de ferro
A imagem superior é uma representação da estrutura cristalina do feio, um dos óxidos de ferro onde o ferro tem valência +2. As esferas vermelhas correspondem aos ânions ou2-, Enquanto os cátions amarelos para fé2+.
Observe que toda fé2+ é cercado por seis ou2-, formando uma unidade de coordenação octaédrica.
Portanto, a estrutura feia pode "desmoronar" em unidades feias6, Onde o átomo central é fé2+. No caso de oxi -hidróxido ou hidróxido, a unidade octaédrica é feia3(OH)3.
Pode atendê -lo: peróxido de cálcio (CaO2): propriedades, riscos e usosEm algumas estruturas, em vez do octaedro, existem unidades tetraédricas, feias4. Por esse motivo, os óxidos de ferro são geralmente representados com outubro ou tetraedra com centros de ferro.
As estruturas de óxidos de ferro dependem das condições de pressão ou temperatura, da fé/ou razão (ou seja, quantos oxigênio existem para ferro e vice -versa), e Valencia del Hierro (+2, +3 e, muito raramente em óxidos sintéticos , +4).
Em geral, os ânions volumosos ou2- Eles alinham as folhas de formação cujos buracos hospedam cátions fé2+ ou fé3+. Assim, existem óxidos (como magnetita) que têm ferros com ambas as valências.
Polimorfismo
Os óxidos de ferro têm polimorfismo, ou seja, estruturas diferentes ou arranjos cristalinos para o mesmo composto. Óxido férrico, fé2QUALQUER3, tem até quatro possíveis polimorfos. A hematita, α-Fe2QUALQUER3, É o mais estável de todos; seguido por Maghemita, ϒ-Faith2QUALQUER3, e para a β-fé sintética2QUALQUER3 e ε- fé2QUALQUER3.
Todos eles têm seus próprios tipos de estruturas e sistemas cristalinos. No entanto, a proporção 2: 3 permanece constante, então existem três ânions ou2- Para cada dois cátions fé3+.
A diferença está em como as unidades octaédricas feias estão localizadas6 no espaço e como eles se juntam.
Links estruturais
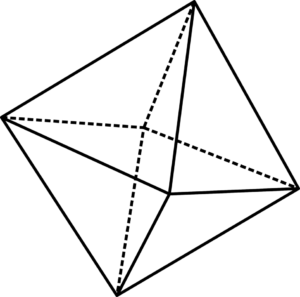 Unidade octaédrica feia6
Unidade octaédrica feia6 As feias unidades octaédricas6 pode ser visualizado com a ajuda da imagem superior. Nos cantos do OctaDro estão o ou2-, Enquanto estava no centro, a fé2+ ou fé3+(No caso de fé2QUALQUER3). A maneira pela qual esses octaedros estão dispostos no espaço revelam a estrutura da ferrugem.
No entanto, eles também influenciam como eles se ligavam. Por exemplo, dois octaedros podem se juntar a dois de seus vértices, que são representados com uma ponte de oxigênio: Fe-O-FE. Da mesma forma, os octaedros podem se juntar às suas bordas (adjacentes entre si). Seria então representado com duas pontes de oxigênio: fe- (o)2-Fé.
Pode atendê -lo: óxido de cloro (v): propriedades, estrutura, usosE, finalmente, o octaedro pode interagir através de seus rostos. Assim, a representação seria agora com três pontes de oxigênio: fe- (o)3-Fé. A maneira pela qual os octaedros estão ligados, as distâncias internucleares Fe variam e, portanto, as propriedades físicas do óxido.
Propriedades dos óxidos de ferro
Um óxido de ferro é um composto com propriedades magnéticas. Estes podem ser anti, Ferro ou ferrimagnéticos, e dependem das valências da fé e de como os cátions interagem em sólidos.
Como estruturas sólidas são muito variadas, da mesma maneira que suas propriedades físicas e químicas são.
Por exemplo, os polimorfos e hidratos de fé2QUALQUER3 Eles têm valores diferentes de pontos de fusão (que variam entre 1.200 e 1.600 ° C) e densidades. No entanto, eles têm pouca solubilidade após a fé3+, A mesma massa molecular é de cores marrons e dificilmente é dissolvida em soluções ácidas.
Nomenclatura de óxidos de ferro
IUPAC define três maneiras de nomear um óxido de ferro. Os três são muito úteis, embora para óxidos complexos (como fé7QUALQUER9) Sistemática governa os outros por sua simplicidade.
Nomenclatura sistemática
Os números de oxigênio e ferro são levados em consideração, nomeando-os com os prefixos de mono-mono-, di-, tri-, etc. De acordo com esta nomenclatura, a fé2QUALQUER3 se chama: Trióxido deuferro. E para a fé7QUALQUER9 O nome dele seria: heptahierro nonxide.
Nomenclatura de ações
Isso considera o Valencia del Hierro. Se for a fé2+, O óxido de ferro está escrito ... e sua valência com números romanos trancados entre parênteses. Para fé2QUALQUER3 Seu nome é: óxido de ferro (iii).
Pode atendê -lo: pressão do vapor: conceito, exemplos e exercícios resolvidosObserve essa fé3+ Pode ser determinado por somas algébricas. Sim2- Tem duas cargas negativas e há três deles, adicione -6. Para neutralizar isso -6, eles exigem +6, mas há duas fé, para que eles sejam divididos por dois, +6/2 = +3:
2x (Valencia de metal) + 3 (-2) = 0
Simplesmente limpar a valência da fé no óxido. Mas se x não é um número inteiro (como quase todos os óxidos restantes), então há uma mistura de fé2+ e fé3+.
Nomenclatura tradicional
O sufixo -ico é concedido ao prefixo Ferr- quando a fé tem Valência +3, e -então quando sua Valência é 2+. Assim, fé2QUALQUER3 é chamado: óxido férrico.
Usos de óxidos de ferro
Nanopartículas
Os óxidos de ferro têm uma alta energia de cristalização, que permite criar cristais muito pequenos, mas com uma grande área de superfície.
Por esse motivo, eles são de grande interesse nos campos da nanotecnologia, onde projetam e sintetizam nanopartículas de óxido (NPs) para fins específicos:
- Como catalisadores.
- Como reservatório de drogas ou genes dentro do corpo.
- No design de superfícies sensoriais para diferentes tipos de biomoléculas: proteínas, açúcares, gorduras.
- Para armazenar dados magnéticos.
Pigmentos
Como alguns óxidos são muito estáveis, eles servem para tingir têxteis ou dar cores brilhantes às superfícies de qualquer material. Dos mosaicos dos pisos -as pinturas vermelhas, amarelas e laranja (até verdes) -, plásticos, couro para trabalhos de arquitetura.
Referências
- Curadores do Dartmouth College (18 de março de 2004). Estequiometria de óxidos de ferro. Retirado de: Dartmouth.Edu
- Ryosuke Sinmyo et al. (8 de setembro de 2016). Descoberta de Fe7QUALQUER9: Um novo óxido de ferro com uma estrutura monoclínica complexa. Recuperado de: natureza.com
- M. Cornell, u. Schwertmann. Os óxidos de ferro: estrutura, propriedades, reação, ocorrências e usos [pdf]. Wiley-VCH. Retirado de: EPSC511.Wustl.Edu

