Óxido de berílio (Beeo)
- 4056
- 472
- Gilbert Franecki
 Estrutura química do óxido beril
Estrutura química do óxido beril O que é óxido beril?
Ele óxido de berílio (Beeo) é um material de cerâmica que, além de sua alta resistência e resistividade elétrica, possui uma capacidade de condução de calor tão alta que torna parte dos reatores nucleares, até superando metais nesta última propriedade.
Além de sua utilidade como material sintético, ele também pode ser encontrado na natureza, embora seja raro. Sua gestão deve ser realizada com cuidado, pois tem a capacidade de danificar seriamente a saúde dos seres humanos.
No mundo moderno, observou -se como os cientistas associados a empresas de tecnologia realizaram pesquisas para desenvolver materiais avançados para aplicações bastante especializadas, como aquelas que atendem aos materiais semicondutores e aos da indústria aeroespacial.
O resultado disso tem sido a descoberta de substâncias que, graças às suas propriedades extremamente úteis e à sua alta durabilidade, nos deram a oportunidade de avançar com o tempo, permitindo -nos levar nossa tecnologia a níveis mais altos.
Estrutura química do óxido beril
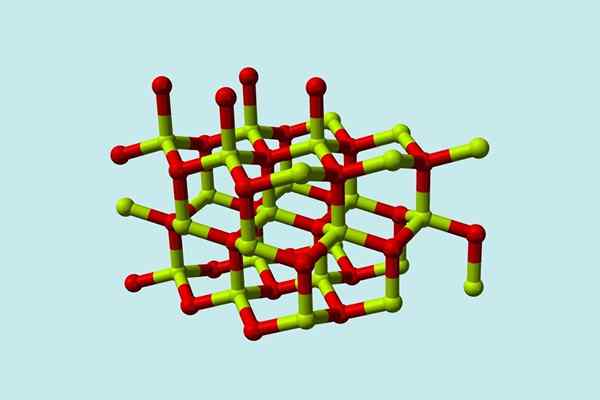
Uma molécula de óxido beril (também chamado Berilia) É composto por um átomo de berílio e um de oxigênio, ambos coordenados na orientação tetraédrica e cristaliza em estruturas cristalinas hexagonais chamadas wurtzitas.
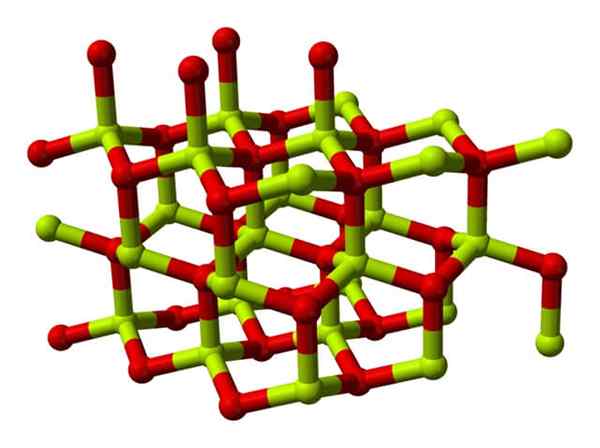 Modelo da estrutura cristalina do óxido beril. Fonte: Wikimedia Commons
Modelo da estrutura cristalina do óxido beril. Fonte: Wikimedia Commons Esses cristais têm centros tetraédricos, que são ocupados por ser2+ EU2-. Em altas temperaturas, a estrutura do óxido de berílio se torna o tipo tetragonal.
A obtenção de óxido beril é alcançada por três métodos: calcinação de carbono beril, desidratação de hidróxido de beryl ou pela ignição do berílio metálico. O óxido de berílio formado em altas temperaturas é inerte, mas pode ser dissolvido por vários compostos.
Pode atendê -lo: ácido clorogênicoBECO3 + Calor → abelha + CO2 (Calcinação)
Seja (oh)2 → Beeo + H2O (desidratação)
2 ser + ou2 → 2 Beeo (ignição)
Finalmente, o óxido de berílio pode ser vaporizado e, neste estado, será apresentado na forma de moléculas diatômicas.
Propriedades do óxido da cunharia
O óxido de berílio é apresentado na natureza como um bromellita, um mineral branco encontrado em alguns depósitos complexos de manganês-hidrone, mas é mais comumente encontrado em sua forma sintética: um sólido amorfo branco que ocorre em forma de poeira.
Além disso, as impurezas que foram presas durante a produção fornecerão cores variadas à amostra de óxido.
Seu ponto de fusão está localizado em 2.507º C, seu ponto de ebulição em 3.900º C e tem uma densidade de 3,01 g/cm3.
Da mesma forma, sua estabilidade química é consideravelmente alta, reagindo apenas com vapor de água em temperaturas próximas a 1.000º C, e pode suportar processos de redução de carbono e ataques a metais fundidos a altas temperaturas.
Além disso, sua resistência mecânica é decente e pode ser melhorada com projetos e fabricação adequada para usos comerciais.
Condutividade elétrica
O óxido de berílio é um material cerâmico extremamente estável e, portanto, possui uma resistividade elétrica bastante alta que o torna um dos melhores materiais isolantes elétricos, juntamente com a alumina.
Por esse motivo, é comumente usado para equipamentos elétricos especializados em alta frequência.
Condutividade térmica
O óxido de berílio tem uma grande vantagem em sua condutividade térmica: é conhecido como o segundo melhor material condutor de calor entre os não -metais, sendo superado apenas por diamante, um material consideravelmente mais caro e raro.
Pode atendê -lo: tiisQuanto aos metais, apenas o cobre e a prata transferem o calor, dirigindo do que o óxido de berílio, tornando -o um material muito desejável.
Devido às suas excelentes propriedades de conduta térmica, essa substância esteve envolvida na produção de materiais refratários.
Propriedades ópticas
Devido às mesmas propriedades cristalinas, o óxido de berílio é usado para a aplicação de material transparente ao ultravioleta em determinadas telas planas e células fotovoltaicas.
Da mesma forma, cristais de alta qualidade podem ocorrer, para que essas propriedades melhorem de acordo com o processo de fabricação usado.
Riscos de saúde
O óxido de berílio é um composto que deve ser manipulado com muito cuidado, pois primeiro possui propriedades carcinogênicas, que foram ligadas à inalação contínua de pós ou vapores deste material.
Pequenas partículas nessas fases de óxido aderem aos pulmões e podem gerar a formação de tumores ou uma doença conhecida como beliose.
A berilaiose é uma doença com uma taxa de mortalidade média que produz respiração ineficiente, tosse, perda de peso e febre, e a formação de granulomas nos pulmões ou outros órgãos afetados.
Também há perigos para o contato direto do óxido de berílio com a pele, pois é corrosivo e irritante, e pode causar danos à superfície da pele e às membranas mucosas. Estradas e mãos respiratórias devem ser protegidas ao trabalhar com este material, especialmente em sua forma de poeira.
Usos de óxido de berílio
Os usos do óxido beril são divididos principalmente em três: aplicações eletrônicas, nuclear e outros.
Pode atendê -lo: o que é o erristenoo?Aplicações eletrônicas
A capacidade de transferir calor para um nível alto e sua boa resistividade elétrica fez com que o óxido de Beleril adquirisse uma grande utilidade como dissipador térmico.
Seu uso em circuitos em computadores de alta capacidade foi evidenciado, além de equipamentos que lidam com altas correntes de eletricidade.
O óxido de berílio é transparente para raios X e microondas, por isso é usado nas janelas contra esses tipos de radiação, além de antenas, sistemas de comunicação e fornos de microondas.
Aplicações nucleares
Sua capacidade de moderar os nêutrons e manter sua estrutura sob radiação Bombard.
Outros aplicativos
A baixa densidade do óxido de berílio gerou interesse nas indústrias aeroespacial e de tecnologia militar, pois pode representar uma opção de baixo peso em motores para foguetes e coletes antibalas.
Finalmente, foi aplicado recentemente como material refratário na fusão de metais nas indústrias metalúrgicas.
Referências
- PubChem (S.F.). Óxido de berílio. Obtido do PubChem.NCBI.Nlm.NIH.Gov
- Reade (S.F.). Óxido de Beryllia/Berílio (BEEO). Leia de Reade.com
- Pesquisa, c. (s.F.). Óxido de berílio - Beryllia. Obtido de Azom.com
- Serviços, n. J. (s.F.). Óxido de berílio. Recuperado de NJ.Gov
- Wikipedia (s.F.). Óxido de berílio. Obtido de in.Wikipedia.org

