Tríades de Döbereiner
- 4426
- 1424
- Gilbert Franecki
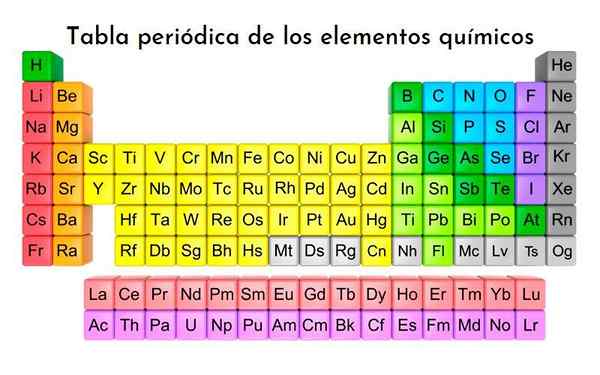
 Tabela periódica dos elementos, todos os elementos químicos até agora descobertos são classificados. Com licença
Tabela periódica dos elementos, todos os elementos químicos até agora descobertos são classificados. Com licença Quais são as tríades de Döbereiner?
As Tríades de Döbereiner Eles são o primeiro experimento em que três elementos químicos foram agrupados que compartilham características semelhantes, associando -os a seus pesos atômicos. Fazem parte dos 118 elementos químicos, sendo a diversidade de reações mostradas e seus compostos sua aparência mais notável.
A idéia de classificar os elementos é lidar adequadamente com suas propriedades químicas sem desenvolver um conjunto de regras e teorias para cada uma delas.
Sua classificação periódica deu uma estrutura sistemática imensamente útil para correlacioná -los de acordo com alguns padrões muito simples e lógicos.
Os elementos são sistematicamente organizados em linhas e colunas com números atômicos crescentes, e o espaço para novas descobertas foi reservado.
Em 1815, apenas cerca de 30 elementos eram conhecidos. Embora houvesse muita informação disponível sobre esses e seus compostos, não havia ordem aparente.
Várias tentativas foram feitas para encontrar a ordem, no entanto, foi difícil.
Descobrir as tríades de Döbereiner
O cientista Johann Wolfgang Döbereiner (1780-1849) fez descobertas importantes sobre a regularidade numérica entre os pesos atômicos dos elementos. Ele foi o primeiro a notar a existência de vários grupos de três elementos, que ele chamou de tríades, que mostravam semelhanças químicas.
Esses elementos revelaram um relacionamento numérico importante, uma vez ordenados de acordo com seu peso equivalente ou atômico, o peso do elemento central provou ser a média aproximada dos dois elementos restantes na tríade.
Pode atendê -lo: fosfato de sódio: estrutura, propriedades, síntese, usosEm 1817, Döbereiner descobriu que, se certos elementos fossem combinados com oxigênio em compostos binários, uma relação numérica poderia ser discernida entre os pesos equivalentes desses compostos.
Assim, quando os óxidos de cálcio, estrôncio e bário foram considerados, o peso equivalente do óxido de estrôncio foi aproximadamente a média de óxido de cálcio e óxido de bário. Dizem que os três elementos em questão, estrôncio, cálcio e bário, formam uma tríade.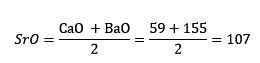
Embora Döbereiner tenha trabalhado com pesos que foram deduzidos de pequenos métodos experimentais rigorosos, mas em vigor para o tempo, seus valores são intimamente bons.
A observação de Döbereiner teve pouco impacto no mundo químico, mas depois se tornou muito influente. Atualmente, é considerado um dos pioneiros do desenvolvimento do sistema periódico.
Doze anos depois, em 1829, Döbereiner adicionou três novas tríades, que são mostradas abaixo:
Grupo de halogênio
Cloro, bromo e iodo têm propriedades químicas semelhantes e formam uma tríade. Esses elementos são metais muito reativos. Se eles estiverem listados na ordem de aumento da massa relativa, eles estão na ordem de diminuição da reatividade. Bromo tem uma massa atômica intermediária entre cloro e iodo.

A massa atômica do bromo médio.
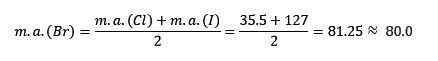
O valor médio obtido está próximo da massa atômica de bromo (BR).
Similaridades em propriedades químicas:
1. Eles são todos não -metais.
2. Todos eles reagem com água para formar ácidos (por exemplo, em: HCl, HBR, HF).
Pode servir a você: Biodiesel: História, Propriedades, Tipos, Vantagens, Desvantagens3. Todo mundo tem uma Valência de um (por exemplo, em: HCl, HBR, HF).
4. Todos eles reagem com metais alcalinos para formar sais neutros (por exemplo, NaCl, Nabab, NAI)
Grupo de metal alcalino
Lítio, sódio e potássio têm propriedades químicas semelhantes e formam uma tríade. Esses elementos são suaves e leves, mas metais muito reativos.
Se eles estiverem listados na ordem de aumento da massa atômica relativa, eles também estão em uma ordem de reatividade crescente. O sódio tem a massa atômica intermediária entre lítio e potássio.

A massa atômica do elemento central de sódio (Na) é igual à média da massa atômica de lítio (Li) e potássio (K).
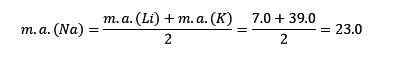
Similaridades em propriedades químicas:
1. Eles são todos metais.
2. Todos reagem com água para formar soluções alcalinas e gás de hidrogênio.
3. Todo mundo tem uma Valencia de One (por exemplo, em: LiCl, NACL, KCL).
4. Seus carbonatos são resistentes à decomposição térmica.
Grupo de calcógenos ou anfumos
Enxofre, selênio e teluro têm propriedades químicas semelhantes e formam uma tríade. O selênio tem a massa atômica intermediária entre enxofre e teluro.

A massa atômica do elemento médio de selênio (SE) é igual às massas atômicas médias de enxofre (s) e teluro (TE).
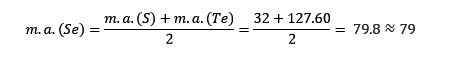
Mais uma vez, o valor médio obtido está próximo da massa atômica de selênio (SE).
Similaridades em propriedades químicas:
1. As combinações com hidrogênios desses elementos resultam em gases tóxicos.
2. Cada um desses elementos tem 6 elétrons de valência.
3. As qualidades de metal aumentam à medida que o número atômico aumenta.
Döbereiner também alertou que, para ser válido, as tríades tiveram que revelar relações químicas entre os elementos, bem como relacionamentos numéricos.
Pode servir você: clorato de potássio (KCLO3)Por outro lado, ele se recusou a agrupar fluoreto junto com cloro, bromo.
Ele também relutou em considerar o aparecimento de tríades entre elementos diferentes, como nitrogênio, carbono e oxigênio, embora eles mostrem um relacionamento numérico triádico significativo.
O trabalho de Döbereiner se concentrou nas relações entre os elementos de uma tríade, mas não deu nenhuma idéia sobre o relacionamento entre eles.
Basta dizer que a investigação de Döbereiner estabeleceu a noção de tríades como um conceito poderoso, que vários outros produtos químicos logo levariam em consideração.
De fato, as tríades de Döbereiner representaram o primeiro passo para agrupar os elementos em colunas verticais dentro da tabela periódica e, assim, estabelecer um sistema que explica as propriedades químicas e revela as relações físicas dos elementos.
Expansão de tríades
Outros produtos químicos estenderam as tríades de Döbereiner para incluir mais do que os três elementos originais. Por exemplo, o fluoreto foi adicionado ao topo da tríade contendo cloro, bromo e iodo.
Outras "tríades" ocorreram, como uma que continha oxigênio, enxofre, selênio e telurio. Mas não havia sistema para correlacioná -los como um todo.
Um dos principais inconvenientes foi que muitas massas atômicas relativas ainda estavam erradas na época.
Referências
- Johann Wolfgang Döbereiner. Recuperado da Britannica.com.
- O que é o grupo 16 da tabela periódica? Como esses elementos são usados? Recuperado do Quora.com.

