Estrutura de torio, propriedades, obtenção, usa

- 2613
- 378
- Ralph Kohler
Ele Torio É um elemento metálico que pertence à série de actinídeos, das terras raras e cujo símbolo químico é o. Tem um número atômico de 90 e um peso atômico de 232 g/mol. Os compostos do Torio geralmente o contêm com o número de oxidação +4 (th4+).
O composto de dióxido de Torio, embora2, É conhecido industrialmente como Toria e é usado na maioria das aplicações do Torium, caracterizado por ser o composto químico com o maior ponto de fusão (3.300 ºC).
 Amostra de tório metálico armazenado em uma bolha de vidro sob argônio. Seu revestimento escuro é devido ao seu óxido. Fonte: Alchemist-HP (Talk) (www.PSE-Mendelejew.de) / fal
Amostra de tório metálico armazenado em uma bolha de vidro sob argônio. Seu revestimento escuro é devido ao seu óxido. Fonte: Alchemist-HP (Talk) (www.PSE-Mendelejew.de) / fal O Torio foi descoberto em 1828 por Mortar Thrane Esmark, que encontrou na ilha norueguesa de Løvøya um mineral preto. Esmark entregou o mineral a Jöns Jacob Berzelius, que o analisou encontrando um metal desconhecido nele.
Ele chamou o mineral negro como Torita (Thorita) em homenagem ao deus escandinavo Thor. Enquanto isso, o metal desconhecido era chamado Torio (tório). O personagem radioativo do tório foi estabelecido por Anton Edward Van Arkel e Jan Hendrik de Boer, e independentemente por Pierre Curie e Marie Curie.
[TOC]
Propriedades do Torium
Físico
O tório é um metal branco radioativo, brilhante, moderadamente duro, prateado, dúctil e maleável, que nega muito lentamente no ar, ficando cinza e depois preto. Pertence ao grupo de actinídeos, identificando -se com o número atômico 90 e um peso atômico de 232 g/mol.
Radioatividade
O Torio-232 (232º90) constitui mais de 99% do elemento total de tório presente no córtex da Terra. Pode -se considerar que é um isótopo estável, apesar de ser radioativo, pois sua meia -vida é 1.405 x 1010 anos. Declara radioativamente por emissão de partículas α e β e radiação γ.
O Torio-232 é transformado no Radio-268 (268Ra88) ao emitir uma partícula alfa, constituída por dois prótons e dois nêutrons. O tório pode sofrer uma série de desintegrações radioativas até que se torne um elemento estável: Lead-208.
Pode atendê -lo: choreto de chumbo: propriedades, estrutura, usosO Torio-232 é capaz de capturar nêutrons para se transformar no elemento radioativo de urânio-233, emitindo radiação do tipo β. O urânio, por outro lado, é usado em reatores nucleares para produção de energia.
Reatividade
O tório é um metal eletropositivo e altamente reativo. Ele oxida muito lentamente no ar, embora a corrosão possa ocorrer após vários meses. Quando aquecido no ar, está ligado, emitindo uma luz branca brilhante enquanto a produção de dióxido de Torio, embora2.
Sob condições padrão de temperatura e pressão, o tório é lentamente atacado pela água. Da mesma forma, o tório não é dissolvido nos ácidos mais comuns, com exceção do ácido clorídrico, onde se dissolve deixando um resíduo preto e insolúvel.
Também é dissolvido em ácido nítrico concentrado com uma pequena quantidade de fluoreto catalítico ou fluorosilicato. O tório é um metal pirofórico: quando fica em pó, é capaz de acender espontaneamente.
Estrutura
Os átomos de torio formam um cristal de estrutura cúbica centrado em faces (FCC) à temperatura ambiente. Quando é aquecido acima de 1360 ºC, o vidro sofre uma transição para a fase cúbica centrada no corpo (BCC), de menor densidade. Enquanto isso, o tório sob altas pressões (100 GPa ou mais) adquire uma densa estrutura tetragonal centrada no corpo (BCT).
Configuração eletronica
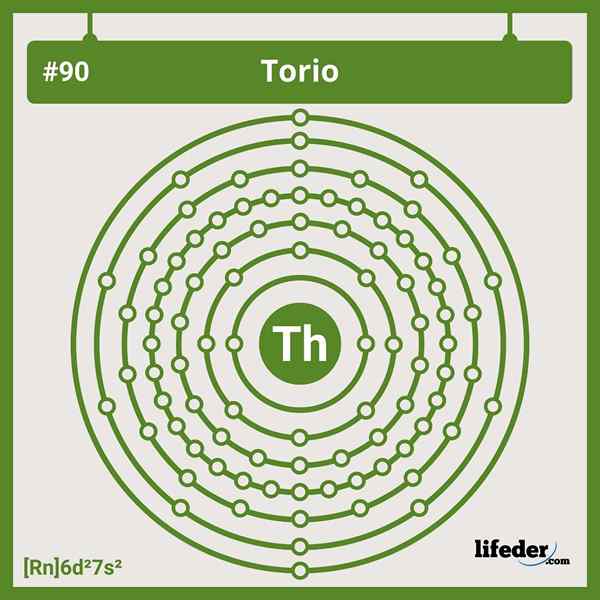 Configurações eletrônicas de torium
Configurações eletrônicas de torium A configuração eletrônica abreviada para o tório é a seguinte:
[RN] 6D2 7s2
Perder seus quatro elétrons de Valência se transforma em THR Cation4+. Observe que, apesar de ser uma atuação, falta elétrons em seus orbitais 5F, em contraste com os outros actinídeos.
Pode atendê -lo: fase de dispersãoObtenção
O principal mineral usado para obter o tório é o monacito. A etapa inicial é sua separação de seu depósito primário: o Pegmatita. Os carbonatos de metais alcalinotherrosos são eliminados do pegmatita por reação de seus fragmentos com cloreto de hidrogênio.
Os fragmentos resultantes são calcinados e filtrados e, em seguida, passando por uma separação magnética. Assim, um material arenoso de Monacita é obtido. Esta areia é submetida a uma digestão com ácido sulfúrico de 93%, a uma temperatura de 210 a 230 ° C e por várias horas. A solução ácida formada é posteriormente diluída com água dez vezes o seu volume.
Os restos mortais de Monacita afundam no fundo, enquanto o tório e os outros elementos da terra rara flutuam na preparação do ácido. PH a 1 é ajustado.3, que produz a precipitação do tório como fosfato, enquanto o restante da terra rara em suspensão permanece em solução.
Atualmente, a separação e a purificação são realizadas usando solventes líquidos, por exemplo, fosfato de tributo em queroseno.
Torio Metal pode ocorrer em quantidades comerciais por redução metalotérmica em Totrafluoruro de Torio (THF4) e Torio Dioxide (Thho2), ou por eletrólise de tetracloreto de tório (THCL4).
Formulários
O tório teve muitas aplicações, muitas das quais foram descartadas desde a década de 1950, porque seu caráter radioativo constituía um risco à saúde.
Industriais
Ligas
O tório foi ligado com o tungstênio como eletrodo na soldagem Tig (gás inerte de tungstênio), constituindo 2% da liga.
Em pequenas quantidades, o Torio foi adicionado aos filamentos de tungstênio para reduzir sua cristalização, permitindo assim que a emissão de elétrons diminua as temperaturas. Os fios de tungstênio-torio foram usados em tubos eletrônicos e nos eletrodos dos tubos de raios-X e retificadores.
O dióxido de torio tem sido usado na soldagem do arco de tungstênio, uma vez que a resistência ao tungstênio a altas temperaturas de eletrodos metálicos aumenta. No entanto, foi substituído nesta aplicação por CircuLisher, Cerio ou Lantano Oxides.
Pode servir você: de onde vem o plástico? História e tiposRaio
Totrafluoruro de torio, por outro.350 a 1.2 µm. No entanto, o sal do Torio foi substituído neste uso pelo tetrafluoruro de lantano.
O dióxido de Torio tem sido usado na iluminação da luz, para emitir uma luz brilhante correspondente à luz visível. Embora o tório ainda esteja sendo usado neste aplicativo, ele foi parcialmente substituído pelo ITE.
Materiais refratários
O tório também tem sido usado na elaboração de materiais refratários para a indústria metalúrgica e em crisolos de cerâmica para laboratórios de ensino e pesquisa.
Reatores nucleares
O Torio-232 é usado em reatores nucleares para capturar nêutrons em câmera lenta, já que isso é transformado em urânio-233. Este elemento radioativo é fisicamente e é usado para produção de energia.
O desenvolvimento de reatores nucleares baseados no Torio-32 foi lento, criando o primeiro reator com essa característica no Indian Point Energy Center, localizado em Buchanan EUA, no ano de 1962. Os reatores nucleares do Torio-232 não emitem plutônio, o que os torna menos poluentes.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (quarta edição). Mc Graw Hill.
- Wikipedia. (2020). Tório. Recuperado de: em.Wikipedia.org
- Centro Nacional de Informações sobre Biotecnologia (2020). Tório. Resumo do PubChem Comunund para CID 23974. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Dr. Doug Stewart. (2020). Fatos do elemento de tório. Recuperado de: Chemicool.com
- Os editores da Enyclopaedia Britannica. (2020). Tório. Recuperado de: Britannica.com
- Lentech b.V. (2020). Tório. Recuperado de: lentech.com
- Rachel Ross. (1 de março de 2017). Fatos sobre tório. Recuperado de: LiveScience.com
- Advameg. (2020). Tório. Recuperado de: química explaada.com

