Tiossulfato de sódio (Na2S2O3)

- 4021
- 864
- Alfred Kub
 Sais de tiossulfato de sódio. Com licença
Sais de tiossulfato de sódio. Com licença O que é tiossulfato de sódio?
Ele tiossulfato de sódio ou hiposulfito de sódio (NA2S2QUALQUER3) É um sal inorgânico importante com vários usos médicos. Também está disponível como seu sal de penta -hidrato (NA2S2QUALQUER3.5h2QUALQUER).
É um composto iônico formado por dois cátions de sódio (NA+) e o ânion tiossulfato carregado negativamente (s2QUALQUER3-), em que o átomo central de enxofre está ligado a três átomos de oxigênio e outro átomo de enxofre (daí o prefixo -tio), através de ligações simples e duplas com caráter. O sólido existe em uma estrutura cristalina monoclínica.
O tiossulfato de sódio pode preparar o enxofre de aquecimento com uma solução aquosa de sulfito de sódio ou uma solução aquosa de hidróxido de sódio.
6naoh + 4s → Na2S2QUALQUER3 + 2º2S + 3h2QUALQUER
Este é um medicamento que está na lista de medicamentos essenciais da Organização Mundial da Saúde, os medicamentos mais eficazes e seguros necessários em um sistema de saúde.
Propriedades físicas e químicas
- O tiossulfato de sódio tem um peso molecular de 158,11 g/mol para forma anidro e 248,18 g/mol para a forma de penta -hidratada.
- Apresenta uma densidade de 1.667 g/ml.
- O tiossulfato de sódio é um cristal monoclínico incolor sem aroma característico. Esse sólido é eflorescente, o que significa que pode ser reduzido a pó por si só pela perda de água de cristalização quando exposta ao ar.
- O composto tem um ponto de fusão de 48 ° C para a forma penta -hidratada e, a partir de 100 ° C, começa a decompor.
- Então uma2S2QUALQUER3 É muito solúvel em água, sendo capaz de dissolver 70 gramas por 100 mililitros de solvente. O composto é praticamente insolúvel em etanol.
Pode atendê -lo: espectro de absorção- O tiossulfato de sódio é um sal neutro que se dissocia facilmente na água para dar íons de sódio e tiossulfato. N / D2S2QUALQUER3 É um sólido estável em condições normais, mas se decompõe quando aquecido para dar sulfato de sódio e polissulfeto de sódio:
4NA2S2QUALQUER3 → 3NA2SW4 + N / D2S5
- Também se decompõe quando tratado com ácidos diluídos para dar dióxido de enxofre e enxofre (reação chamada relógio):
N / D2S2QUALQUER3 + 2HCL → 2NACL + S + SO2 + H₂o
- Reaja estequiometricamente (em quantidades equimolares) com soluções aquosas de iodo, por isso é amplamente utilizado em laboratórios para graus baseados em iodo.
Reatividade e perigos
O tiossulfato de sódio não é um material tóxico e é usado para fins médicos. No entanto, quando se decompõe, produz vapores tóxicos de óxido de enxofre, o que pode causar irritação nos olhos, pele e membranas mucosas.
O composto pode irritar os olhos, a pele e o trato respiratório. A substância é tóxica para os pulmões e membranas mucosas. A exposição repetida ou prolongada à substância pode causar danos a esses órgãos.
Se o composto entrar em contato com os olhos, as lentes de contato devem ser verificadas e removidas, no caso de carregá -las. Os olhos com muita água devem ser lavados imediatamente por pelo menos 15 minutos com água fria.
Em caso de contato com a pele, a área afetada por pelo menos 15 minutos deve ser lavada imediatamente, enquanto as roupas e sapatos contaminados são removidos.
Você tem que cobrir a pele irritada com um emoliente. Lave roupas e sapatos antes de usá -los novamente. Se o contato for grave, lave com um sabão desinfetante e cubra a pele contaminada com um creme antibacteriano.
Pode atendê -lo: oxigênio: propriedades, estrutura, riscos, usosEm caso de inalação, a vítima deve ser transferida para um novo local. Se você não respirar, a respiração artificial é administrada. Se a respiração for difícil, o oxigênio deve ser fornecido.
Se o composto for ingerido, o vômito não deve ser induzido, a menos que o pessoal médico o indique. Solte roupas apertadas, como pescoço, cinto ou gravata de camisa.
Em todos os casos, deve ser obtido assistência médica imediata.
Formulários
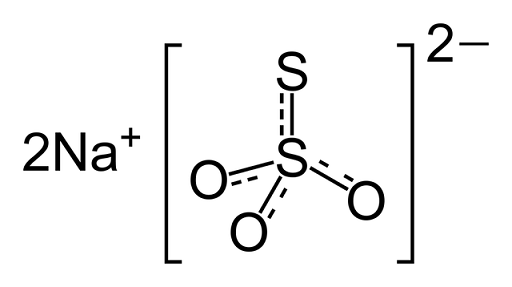 Estrutura química do tiossulfato de sódio
Estrutura química do tiossulfato de sódio Medicamento
- O tiossulfato de sódio pode ser usado para reduzir alguns dos efeitos colaterais da cisplatina (um medicamento para o câncer).
- É usado no manejo do extravasamento durante a quimioterapia. O tiossulfato de sódio impede a alquilação e a destruição do tecido, fornecendo um substrato para agentes alugados que invadiram tecidos subcutâneos.
- Também é usado com outro remédio no tratamento de emergência de envenenamento por cianeto.
Neste tratamento, o nitrito de sódio é injetado por via intravenosa para produzir hemoglobina que é combinada com o íon cianeto, transformando -o temporariamente na forma da cianemetoglobina. Posteriormente, o tiossulfato de sódio é injetado.
- Serve como substrato para a enzima Rodanasa, que catalisa a conversão de cianeto no tiocianato muito menos tóxico, que é excretado na urina.
- Também é usado como tratamento de calcifilaxia em pessoas em hemodiálise com doença renal terminal. Aparentemente, há um fenômeno não completamente compreendido, pelo qual isso causa acidose metabólica grave em alguns pacientes.
Iodometria
- O tiossulfato de sódio reage estequiometricamente com iodo para dar iodeto de acordo com a reação:
Pode atendê -lo: cetonas: tipos, propriedades, nomenclatura, usos, exemplos2º2S2QUALQUER3 + I2 → s4QUALQUER62− + 2i-
Esta propriedade torna o composto usado como um título na determinação do iodo.
- Esse uso em particular pode ser estabelecido para medir o teor de oxigênio da água através de uma longa série de reações no teste de Winkler para oxigênio dissolvido.
- Também é usado na estimativa volumétrica das concentrações de certos compostos em solução (peróxido de hidrogênio, por exemplo) e na estimativa do teor de cloro no pó de alvejante comercial e na água.
Águas de água
- O tiossulfato de sódio é usado para divulgar água, incluindo a redução dos níveis de cloro para uso em aquários e piscinas e spas e dentro das estações de tratamento de água para tratar a água de lavagem posterior estabelecida antes de sua liberação nos rios.
A reação de redução é análoga à reação de redução de iodo, o tiossulfato reduz o hipoclorito (ingrediente ativo no alvejante) e, ao fazê -lo, oxida -se em sulfato. A reação completa é:
4NACLO + NA2S2QUALQUER3 + 2NAOH → 4NACL + 2NA2SW4 + H2QUALQUER
Extração de ouro
O tiossulfato de sódio é um componente usado como um agente alternativo de lixiviação ao cianeto para extração de ouro. No entanto, ele forma um forte complexo solúvel com íons dourados (i), [Au (S2QUALQUER3)2]3-.
A vantagem dessa abordagem é que o tiossulfato não é essencialmente tóxico e que os tipos de mineral que são refratários à cianração de ouro podem ser lixiviados pelo tiossulfato.
Referências
- HSDB: tiossulfato de sódio. Recuperado do toxnet.Nlm.NIH.Gov.
- Folha de dados de segurança tiossulfato anidro Material anidro. Recuperado do Sciencelab.com.

