Coloração de Ziehl-Neelsen
- 1836
- 297
- Gilbert Franecki
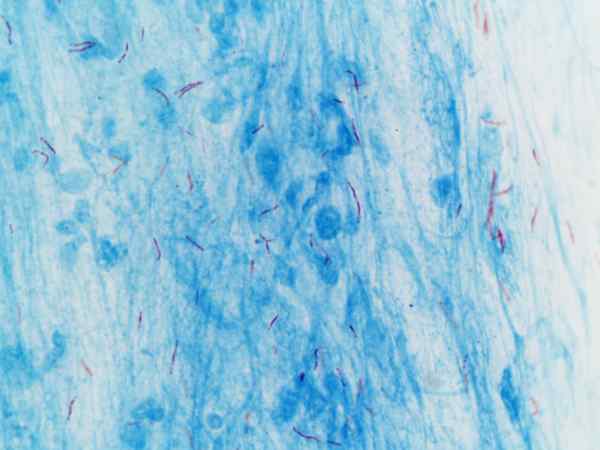
 Mycobacterium tuberculosis visualizada com manchas de ziehl-neelsen
Mycobacterium tuberculosis visualizada com manchas de ziehl-neelsen O que é a coloração de Ziehl-Neelsen?
O Coloração de Ziehl-Neelsen Em uma técnica de coloração para identificar microorganismos resistentes de ácido álcool (AAR). O nome deste procedimento de microbiologia refere -se a seus autores: o bacteriologista Franz Ziehl e o patologista Friedrich Neelsen.
Esta técnica é um tipo de cor diferencial, que implica o uso de diferentes corantes, a fim de criar contraste entre as estruturas que desejam observar, diferenciar e posteriormente identificar. A coloração de Ziehl-Neelsen serve para identificar certos tipos de microorganismos.
Alguns desses microorganismos são micobactérias (por exemplo, Mycobacterium tuberculosis), Nocardias (por exemplo, Nocardia sp.) e alguns parasitas unicelulares (por exemplo, Cryptosporidium parvum). Muitas das bactérias podem ser classificadas através de uma técnica comum chamada Gram Stating.
No entanto, alguns grupos bacterianos exigem outros métodos para identificá -los. Técnicas como a coloração com Ziehl-Neelsen requerem combinações de calor com calor para consertar o primeiro na parede celular.
Depois vem um processo de descoloração que permite obter dois resultados: resistência ou sensibilidade ao ácido e descoloração dos álcoois.
Base
A base dessa técnica de coloração é baseada nas propriedades da parede celular desses microorganismos. A parede é formada por um tipo de ácidos graxos chamados ácidos micólicos; Estes são caracterizados por apresentar correntes muito longas.
Quando os ácidos graxos têm estruturas muito longas, elas podem reter os corantes com mais facilidade. Alguns gêneros de bactérias são muito difíceis de tingir por coloração com grama, devido ao alto teor de ácidos micólicos da parede celular.
Na coloração de Ziehl-Neelsen, é usado o composto fenólico da fenólica da fúcsina, um corante básico. Isso tem a capacidade de interagir com os ácidos graxos da parede celular, que é da textura de cerosa à temperatura ambiente.
Pode atendê -lo: monossaccharidesA mancha com fuchsin carbol é melhorada na presença de calor, porque a cera derrete e as moléculas para colorir se movem mais rapidamente para a parede celular.
O ácido usado posteriormente serve para descolorir as células que não foram tingidas porque sua parede não estava relacionada ao corante; Portanto, a força do ácido ácido é capaz de eliminar o corante ácido. As células que resistem a essa descoloração são chamadas de ácido resistente.
Corante secundário
Após a descoloração da amostra, isso é contrastado com outro corante chamado corante secundário. Mustileo azul ou verde malaquita geralmente é usado.
O corante secundário mancha o material de fundo e, consequentemente, cria contraste com as estruturas que foram tingidas no primeiro passo. Somente as células descoloridas absorvem o segundo corante (contra-tittion) e pegam sua cor, enquanto as células resistentes ao ácido retêm a cor vermelha.
Este procedimento é freqüentemente usado para a identificação de Mycobacterium tuberculosis e Mycobacterium leprae, que são chamados bacilos resistentes de álcool ácido.
Reagentes
Corante primário
A 0,3 % de carbol de fuchsina é usada (filtrada). Este corante é preparado a partir de uma mistura de álcoois: etanol fenol (90 %) ou metanol (95 %), e nesta mistura 3 gramas de dissolução básica de fucsina.
Solução de descoberta
Nesta etapa, você pode usar soluções de 3 % de ácido álcool ou 25 % de ácido sulfúrico.
Coloração secundária (contra-colares)
O corante mais usado para contrastar nas amostras é geralmente a 0,3 % de azul de metileno. No entanto, outros também podem ser usados, como 0,5 % de verde malaquita.
Pode servir você: TiminaTécnica
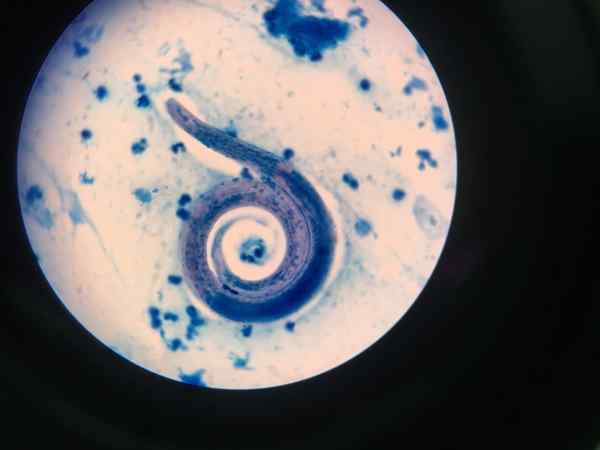 Nematodo exibido com Ziehl-Neelsen
Nematodo exibido com Ziehl-Neelsen Procedimento de coloração com ácido operado
Prepare um esfregaço bacteriano
Esta preparação é feita em um slide limpo e seco, seguindo as precauções de esterilidade.
Frovis secando
Deixe o mancha secar à temperatura ambiente.
Aqueça a amostra
A amostra deve ser aquecida aplicando fogo ao slide abaixo. Uma fixação com álcool pode ser feita quando o cheiro não estiver preparado com escarro (tratado com hipoclorito de sódio para branquear) e se não for tingido imediatamente.
M. tuberculose é eliminado com alvejante e durante o processo de coloração. A termofixação do escarro não tratado não vai matar M. tuberculose, Enquanto a fixação do álcool é bactericida.
Cubra a mancha
A mancha é coberta com a solução Fuchsin Carbol (coloração básica primária).
Aqueça a mancha
Isso é feito por 5 minutos. Você deve notar um descolamento de vapor (aproximadamente 60 ° C). É importante não superaquecer e evitar queimar a amostra.
Em relação ao aquecimento da mancha, você deve ter muito cuidado ao aquecer o carbol de fúcsin, especialmente se a mancha for realizada em uma bandeja ou outro recipiente no qual produtos químicos altamente inflamáveis foram coletados da coloração anterior anterior.
Apenas uma pequena chama deve ser aplicada sob os slides usando uma iluminação de swab anteriormente umedecida com algumas gotas de álcool ácido, metanol ou 70 % de etanol. Evite usar um swab grande embebido em etanol, porque este é um risco de fogo.
Lave a mancha
Esta lavagem deve ser feita com água limpa. Se a água da torneira não estiver limpa, lave a esfregar com água filtrada ou destilada, de preferência.
Cubra a mancha com álcool ácido
Este álcool ácido deve estar em 3 %. A cobertura é realizada por 5 minutos ou até que o cheiro seja suficientemente descolorido, isto é, rosa pálido.
Pode atendê -lo: epiblastoDeve -se levar em consideração que o álcool ácido é inflamável; Portanto, deve ser usado com muito cuidado. Evite estar perto de fontes de ignição.
Lave a mancha
A lavagem deve ser com água limpa e destilada.
Cubra a mancha com corante
Pode ser uma cor verde malaquita (0,5 %) ou azul de metileno (0,3 %) por 1 ou 2 minutos, usando o tempo mais alto se o cheiro for fino.
Lave a mancha
Água limpa (destilada) deve ser usada novamente.
Drenar
A parte de trás da lâmina deve ser limpa e a mancha é colocada em uma prateleira de drenagem, para que seque no ar (não use papel absorvente para secar).
Examine a mancha no microscópio
O objetivo de 100x e óleo de imersão deve ser usado. Digitalize a mancha sistematicamente e anote as observações relevantes.
Interpretar os resultados
Teoricamente, os microorganismos que são tingidos a partir de uma cor avermelhada são considerados ácidos alcoólicos positivos (AAR+).
Pelo contrário, se os microorganismos são tingidos em azul ou verde, dependendo do corante usado como colares de contra-colares, eles são considerados ácido negativo resistente (AAR-).
Referências
- Apurba, s. & Sandhya, B. (2016). Itens essenciais da microbiologia prática (1ª ed.). Jaypee Brothers Medical Publishers.
- Bauman, r. (2014). Microbiologia com Deseodas por sistema corporal (4ª ed.). Pearson Education, Inc.
- Heritage, J., Evans, e. & Killington, um. (mil novecentos e noventa e seis). Microbiologia introdutória (1ª ed.). Cambridge University Press.
- Morello, J., Granato, p. Wilson, m. & Morton, V. (2006). Manual de laboratório e pasta de trabalho em microbiologia: aplicações ao atendimento ao paciente (11ª ed.). Educação McGraw-Hill.
- Vasanthakumari, r. (2007). Livro de Microbiologia (1ª ed.). B.Yo. Publicações Unip.

