Coloração de esporos
- 2726
- 623
- Mr. Reginald Lindgren
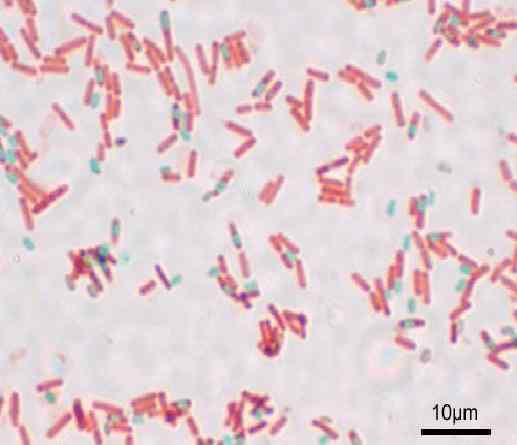
 Coloração de esporos pelo método Shaeffer-Fulton ou Wirtz-Conklin. Fonte: Y também (Uploader original) [GFDL (http: // www.gnu.Org/copyleft/fdl.html) ou cc-be-sa-3.0, Wikimedia Commons
Coloração de esporos pelo método Shaeffer-Fulton ou Wirtz-Conklin. Fonte: Y também (Uploader original) [GFDL (http: // www.gnu.Org/copyleft/fdl.html) ou cc-be-sa-3.0, Wikimedia Commons Qual é a coloração de esporos?
O Coloração de esporos É a metodologia usada para pintar as estruturas de resistência que formam alguns gêneros bacterianos quando estão em condições desfavoráveis. Serve para identificar bactérias.
Existem muitos gêneros que formam esporos, no entanto, os principais são Bacilo e Clostridium. Esses gêneros são considerados mais relevantes porque têm espécies patogênicas para o ser humano.
Cada bacilus pode dar origem a um esporo. No momento de tingir a preparação, o esporo pode ser encontrado dentro do Bacillus (Endospora) ou fora disso (Exospora). Com técnicas de coloração convencionais para bactérias - como a coloração de grama - os esporos são incolores.
Atualmente, existem várias metodologias de coloração capazes de atravessar a estrutura espessa do esporo para tingir. Essas metodologias são muito variadas, e a técnica de Dorner, a coloração de Möeller e a metodologia Shaeffer-Fulton, também conhecidas como Wirtz-Conklin.
De todas as técnicas mencionadas, a metodologia de Shaeffer-Fulton é a mais usada em laboratórios de rotina. Deve seu nome a dois microbiologistas que criaram a coloração em 1930: Alicia Shaeffer e MacDonald Fulton. No entanto, às vezes a técnica é chamada Wirtz-Conklin em homenagem a dois bacteriologistas de 1900.
Base
Os esporos não são tingidos com colorações convencionais porque têm uma parede muito grossa. A composição complexa dos esporos impede a entrada da maioria dos corantes.
Se o esporo de fora for estudado para dentro, as seguintes camadas são observadas: primeiro, há o exosporium, que é a melhor e mais externa camada formada por glicoproteínas.
Depois vem a cutícula, que fornece resistência a altas temperaturas, seguidas pelo córtex composto por peptidoglicano. Posteriormente, existe a base da base que protege o protoplast.
O esporo é uma estrutura desidratada que contém 15% de cálcio e ácido dipicolina. Portanto, a maioria das técnicas de coloração dos esporos são baseadas na aplicação de calor para que o corante possa penetrar na estrutura espessa.
Pode atendê -lo: lactogênese: características e estágiosUma vez que o esporo está manchado, ele não pode eliminar o corante. Na técnica Shaeffer-Fulton, o verde de Malachite entra em células vegetativas e, aplicando calor, penetra na Endospora.
Ao lavar com água, o corante é removido da célula vegetativa. Isso ocorre porque o corante verde da malaquita é um pouco básico, então a célula vegetativa se liga fracamente.
Em vez disso, você não pode sair do esporo e, finalmente. Esta base é válida para o restante das técnicas, nas quais algo semelhante acontece.
Técnicas de coloração de esporos
Para realizar a coloração de esporos, você deve ter uma colheita pura da tensão suspeita que deseja estudar.
A colheita é submetida a temperaturas extremas por 24 horas para estimular o microorganismo a esporulares. Para isso, a colheita pode ser colocada em um 44 ° C ou na geladeira (8 ° C) por 24 ou 48 horas.
Se você deixar muito tempo nas temperaturas acima mencionadas, apenas o exospaurs será observado, pois todos os endosporos deixarão o Bacillus.
Tempo culminado, algumas gotas de solução fisiológica estéril em uma lâmina limpa devem ser colocadas. Então uma pequena parte da colheita é tomada e uma multa estendida.
Posteriormente, é permitido secar, é fixado no calor e no corante com algumas das técnicas explicadas abaixo:
Técnica de Dorner
- Prepare -se em um tubo de ensaio uma suspensão concentrada do microrganismo esporulado em água destilada e adicione um volume igual de fenicada fuchsina de filtro de Kinyoun.
- Coloque o tubo em um banho com água fervente por 5 e 10 minutos.
- Em um slide limpo misturou uma gota da suspensão anterior com uma gota de solução aquosa de nigrosina a 10%, cozida e filtrada.
- Estender e secar com calor macio.
- Examine com o alvo 100x (imersão).
Os esporos são tingidos em vermelho e as células bacterianas parecem quase incolores contra um fundo cinza escuro.
Pode servir a você: Helmintology: Origin, que estudos, exemplo de pesquisaTécnica Dorner modificada
- Um estendido de uma suspensão do microrganismo esporulado é feito em um slide e fixado para aquecer.
- A amostra é coberta com uma tira de papel de filtro à qual a fenicada fuchsin é adicionada. O corante é aquecido de 5 a 7 minutos com a chama do isqueiro de Bunsen até que o destacamento de vapor seja gerado. Então o papel é retirado.
- A preparação com água é lavada e depois seca com papel absorvente.
- O mancha é coberto com um filme fino de 10%de nigrosina, usando um segundo slide para estender a nigrosina ou uma agulha.
A coloração tirada por esporos e bactérias é igual à descrita na técnica anterior.
Técnica Shaeffer-Fulton ou Wirtz-Conklin
- Faça uma multa estendida com uma suspensão de microorganismo esporulado em um slide e conserte o calor.
- Cubra o slide com solução aquosa de malaquita verde a 5% (um papel de filtro pode ser colocado na folha).
- Aqueça na chama do isqueiro de Bunsen até causar descolamento de vapor e remover a chama. Repita a operação de 6 a 10 minutos. Se durante o procedimento a solução verde malaquita evapora, mais poderá ser adicionado.
- Remova o papel de filtro (se colocado) e lave com água.
- Cubra o slide com safranina aquosa a 0,5% por 30 segundos (algumas variantes da técnica usam safranina aquosa a 0,1% e deixe -a por 3 minutos).
Com esta técnica, os esporos são apresentados verdes e os bacilos vermelhos.
Tem a inconveniência de que os endosporos de culturas jovens não sejam bem tingidas, pois parecem extremamente claras ou incolores. Para evitar isso, é recomendável usar as culturas de 48 horas de incubação.
Técnica Möeller
- Cubra a mancha com clorofórmio por 2 minutos.
- Descarte a clorofórmio.
- Cubra com 5% de ácido crômico por 5 minutos.
- Lave com água destilada.
- A folha com carbol de fenicada fucsin é coberta e exposta à chama do Bunsen mais leve até a emissão de vapores, então ela é removida da chama alguns momentos. A operação é repetida até 10 minutos.
- Lave com água.
- Use etanol acidificado (álcool clorídrico) para descolorir. Fica por 20 ou 30 segundos.
- Lave com água destilada.
- Contrate cobrindo a folha com azul de metileno por 5 minutos.
- Lave com água destilada.
- É permitido secar e levar a amostra para o microscópio.
Os esporos parecem vermelhos e os bacilos azuis. É importante não aspirar aos vapores, pois são tóxicos e a longo prazo, podem ser carcinogênicos.
Técnica Möeller modificada sem calor
Em 2007, Hayama e seus colaboradores criaram uma modificação da técnica de Möeller. Eles eliminaram a coloração do corante e o substituíram com a adição de 2 gotas do surfactante Tergitol 7 para cada 10 ml de solução de carbol fenizada por fúcsina. Os mesmos resultados foram obtidos.
Formulários
A coloração dos esporos fornece informações muito valiosas e úteis para a identificação do patógeno, uma vez que a presença da mesma, sua forma, localização dentro do Bacillus e a capacidade de deformar a célula vegetativa ou não, são dados que podem orientar as espécies em as espécies envolvidas em um certo gênero.
Nesse contexto, vale a pena dizer que os esporos podem ser redondos ou ovais, eles podem ser localizados no centro ou também em uma posição palacentral, subterminal ou terminal.
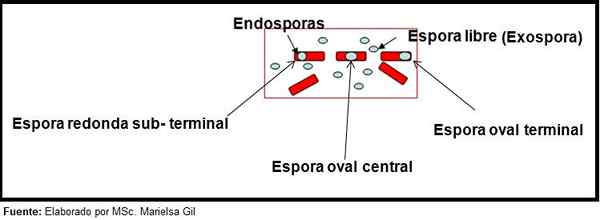 Esquema da forma e posição de endosporos e exosporos
Esquema da forma e posição de endosporos e exosporos Exemplos
- Clostridium difficile Forma um esporo oval em uma posição terminal que deforma o bacilus.
- O esporo de Clostridium Tertium É oval, não deforma o Bacillus e está localizado no nível do terminal.
- A endospora de Clostridium Tetani É terminal e deforma o Bacillus, dando a aparência de um tambor.
- Os esporos de Clostridium botulinum, C. histolyticum, C. Novy e C. sépticos Eles são redondos ou ovais, subterrâneos e deformam o Bacillus.
- A endospora de Clostridium Sordelli Está localizado na posição central, com uma leve deformação.
Referências
- Mancha de Moeller. Recuperado de.Wikipedia.org.
- Endospora. Recuperado de es.Wikipedia.org.
- Forbes, b., Sahm, d., Weissfeld, a. Diagnóstico microbiológico de Bailey & Scott. Pan -American Editorial S.PARA.

