Fornecer características diversas, estrutura, funções
- 3756
- 298
- Ralph Kohler
As Dismutas Superóxido (Sod) qualquer Superóxido oxidortado, Eles compõem uma família de enzimas onipresentes na natureza, cuja principal função consiste na defesa dos organismos aeróbicos contra radicais sem oxigênio, especialmente os radicais aniônicos superóxidos.
A reação que essas enzimas catalisam ocorre virtualmente em todas as células capazes de respirar (aeróbica) e é essencial para sua sobrevivência, pois elimina tóxicos radicais livres de oxigênio, tanto em eucariotos quanto em procariontes.
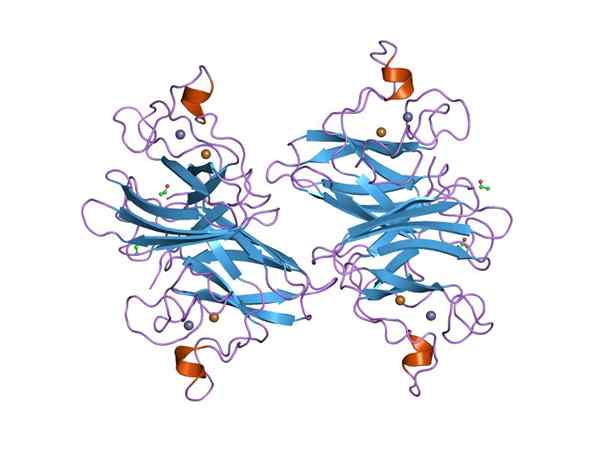
 Representação gráfica de um superóxido de Dyputase (SOD) Cu-ZN (Fonte: Jawahar Swaminathan e MSD funcionários do Instituto Europeu de Bioinformática [Domínio Público] via Wikimedia Commons) via Wikimedia Commons)
Representação gráfica de um superóxido de Dyputase (SOD) Cu-ZN (Fonte: Jawahar Swaminathan e MSD funcionários do Instituto Europeu de Bioinformática [Domínio Público] via Wikimedia Commons) via Wikimedia Commons) Muitas doenças nos animais estão relacionadas ao acúmulo de diferentes espécies reativas de oxigênio, e o mesmo se aplica às plantas, dado que o ambiente impõe numerosos e constantes tipos de estresse oxidativo que são superados graças à atividade de desanimar o superóxido.
Este grupo de enzimas foi descoberto em 1969 por McCord e Fridovich e, desde então, foram feitos avanços consideráveis em relação a essas enzimas e às reações que catalisam os seres vivos.
[TOC]
Caracteristicas
Dismutas superóxido reage com os radicais superxidados a taxas verdadeiramente altas, o que se traduz em uma linha de defesa muito eficaz para a remoção dessas moléculas.
Nos mamíferos, pelo menos três isoformas foram descritas para dismutase de super -exide conhecida como SOD1, SOD2 e SOD3, respectivamente.
Dois desses isoformas têm átomos de cobre e zinco em seus centros catalíticos e diferem entre si em termos de sua localização: intracelular (citosólico, SOD1 ou Cu/Zn-SOD) ou com elementos extracelulares (EC-SOD ou SOD3).
A isoforma SOD2 ou Mn-SOD, ao contrário dos dois anteriores, tem um átomo de manganês como cofator e sua localização parece restrita às mitocôndrias das células aeróbicas.
As isoenzimas SOD1 estão principalmente em citosol, embora também tenham sido detectadas no compartimento nuclear e nos lisossomos. SOD 3 isoenzimas, pelo contrário, foram descritas no plasma sanguíneo dos seres humanos, em linfonodos e fluidos cerebrais.
Pode atendê -lo: como os seres vivos mudam com o tempo?Cada uma dessas isoformas é codificada por genes diferentes, mas pertencente à mesma família e sua regulação transcricional é essencialmente controlada por condições extra-intracelulares, que desencadeiam diferentes cachoeiras de sinalização interna.
Outro superóxido desgosto
Superóxido dismônico com locais catalíticos com íons de cobre e zinco ou manganês não são exclusivos dos mamíferos, eles também estão presentes em outros organismos que incluem plantas e bactérias de diferentes classes.
Há um grupo adicional de superóxido de dismutas, que não é encontrado em mamíferos, e que é facilmente reconhecível, pois em seu lugar ativo eles têm ferro em vez de qualquer um dos três íons descritos anteriormente para as outras classes de superóxido dismatoso.
Em E. coli, O dismi de sobre -corxido -em que contém ferro é uma enzima perplásica também responsável pela detecção e eliminação de radicais livres de oxigênio gerados durante a respiração. Esta enzima é semelhante à encontrada nas mitocôndrias de muitos eucariotos.
As plantas têm os três tipos de enzimas: aquelas que contêm cobre e zinco (Cu/Zn-SOD), que contêm manganês (Mn-SOD) e aqueles que contêm ferro (Fe-SOD) em seu centro ativo e nesses organismos que eles exercitam funções análogas para as de enzimas não vegetais.
Reação
Os substratos enzimáticos dismia-superoxido são ânions de superóxido, que são representados como O2- e que são compostos intermediários no processo de redução de oxigênio.
A reação que eles catalisam pode ser contemplada em linhas gerais, como a transformação (disputa) de radicais livres para a formação de oxigênio molecular e peróxido de hidrogênio, que são liberados ao meio ambiente ou funcionários como substrato de outras enzimas, respectivamente.
Pode atendê -lo: glucans: estrutura, características e funçõesO peróxido de hidrogênio pode ser posteriormente eliminado das células, graças à ação de qualquer uma das enzimas de glutationa, mas peroxidase e catalase, que também exercem funções importantes na proteção celular.
Estrutura
Dismutas Superóxido isoenzimas em humanos podem diferir entre si em termos de certos aspectos estruturais. Por exemplo, a isoenzima SOD1 é de 32 kDa de peso molecular, enquanto SOD2 e SOD3 são homoteétricos de 95 e 135 kDa peso molecular, respectivamente.
O outro grupo de superóxido dismatoso, o Fe-Sod presente em plantas e outros organismos que não os mamíferos, são enzimas dimérrica de subunidades idênticas, ou seja, são homodímeros.
Em algumas plantas, esses Sod Fe contêm uma sequência de sinal n-terminal putativa para o transporte no interior dos cloroplastos e outros contêm uma sequência C-terminal de transporte de triiquador para peroxissomos, por isso presume-se que sua distribuição subcelular seja restrita a ambos os compartimentos.
A estrutura molecular dos três tipos de enzimas de superexídio é consultada, em essência, por hélices alfa e folhas de alcance B.
Funções
O superóxido dismônico defende células, órgãos e tecidos corporais de danos que os radicais isentos de oxigênio podem causar como peroxidação lipídica, desnaturação de proteínas e mutagênese do DNA.
Nos animais, essas espécies reativas também podem causar lesões cardíacas, acelerar o envelhecimento e participar do desenvolvimento de doenças inflamatórias.
As plantas também requerem a atividade enzimática essencial da dismutase de superexídio, uma vez que muitas condições estressantes do ambiente aumentam o estresse oxidativo, ou seja, a concentração de espécies reativas deletâneas.
Em humanos e outros mamíferos, as três isoformas descritas para dismutase de super corxido têm funções diferentes. A isoenzima SOD2, por exemplo, participa de diferenciação e tumorogênese celular e também em proteção contra a toxicidade pulmonar induzida por hiperóxia (alta concentração de oxigênio).
Pode atendê -lo: inulina: estrutura, propriedades, alimentos, contra -indicaçõesPara algumas espécies de bactérias patogênicas, as enzimas SOD funcionam como "fatores de virulência" que lhes permitem superar muitas barreiras de estresse oxidativo às quais podem enfrentar durante o processo de invasão.
Doenças relacionadas
Uma diminuição na atividade da dismutase de superóxido pode ser dada por vários fatores, tanto internos quanto externos. Alguns estão relacionados a defeitos genéticos diretos em genes de codificação para enzimas SOD, enquanto outros podem ser indiretos, relacionados à expressão de moléculas regulatórias.
Um grande número de condições patológicas dos seres humanos está relacionado a enzimas SOD, incluindo obesidade, diabetes, câncer e outros.
Com relação ao câncer, foi determinado que há um grande número de tipos de tumores de câncer que possuem baixos níveis de qualquer um dos três superóxido de mamíferos (SOD1, SOD2 e SOD3).
O estresse oxidativo que a atividade da superóxido dismutase impede também está associado a outras patologias articulares, como osteoartrite, artrite reumatóide. Muitas dessas doenças têm a ver com a expressão de fatores que inibem a atividade da SOD, como o fator TNF-α.
Referências
- Fridovich, i. (1973). Swiden Dysmuta. Annu. Rev. Biochem., 44, 147-159.
- Johnson, f., & Giulivi, c. (2005). Superóxido dismutas e o impacto de IM na saúde humana. Aspectos da medicina molecular, 26, 340-352.
- Oberley, l. C., & Bueftner, G. R. (1979). Papel da superóxido distina no câncer: uma revisão. Pesquisa sobre câncer, 39, 1141-1149.
- Taylor, p., Jogador, c., Acampamento, w. Van, Montagu, M. Van, inzé, D., & Assado, k. (2012). Superóxido demitido em plantas. Revisões críticas em ciências vegetais, 13(3), 37-41.
- Zelko, i., Mariani, t., & Folz, r. (2002). Família multigeno de superóxido Distam: em comparação das estruturas do gene SOD1), Mn-SOD (SOD2) e EC-SOD (SOD3). Biologia e medicina de radicais livres, 33(3), 337-349.
- « Características, composição, funções, tipos de oligossacarídeos
- José Rubén Romero Biografia, Estilo, Trabalha »

